Por: Camila Oliveira Silva Souza e Cesar Speck (doutorandos IBA-FMRP/USP)
Editora: Luciana Benevides
E mais uma vez o sal é o protagonista da vez, sim ele mesmo, quimicamente conhecido como NaCl, presente diariamente na nossa alimentação. Quem nunca colocou uma “pitadinha” à mais de sal na comida?! Ou mesmo comeu sal puro – no “shot” de tequila?! Entretanto, o equilíbrio é fundamental! Quem alerta desta vez, são as células T reguladoras (Tregs), que atuam regulando as respostas imunes exacerbadas em diversos contextos patológicos como: doenças autoimunes, inflamatórias, metabólicas e câncer (1). As células Tregs se diferenciam das células T naive, e têm como principal fator de transcrição o Foxp3, estas células controlam as repostas inflamatórias pelo contato células-células e liberação de mediadores anti-inflamátorios como a IL-10 (2). A disfuncionalidade das células Tregs está associada ao desenvolvimento de doenças autoimunes como Lúpus Eritematoso Sistêmico (SLE) e Artrite Reumatoide (AR) (3). Porém, as células Tregs – Foxp3+ possuem plasticidade funcional, e passam a expressar elevados níveis de IFN-g (citocinas pró-inflamatórias) em indivíduos com esclerose múltipla (EM), e este aumento está associado a sinalização via eixo PI3K-AKT- FOXO1/3 (4). Curiosamente, pacientes com EM apresentam um maior depósito de NaCl no córtex cerebral durante a doença ativa (5). Estudos têm evidenciado que altas concentrações de NaCl levam a ativação da via p38/MAPK levando a ativação de NFAT5 e SGK1 (Serum-Glucocorticoid Regulated Kinase-1) levando o aumento de células Th17. As células Th17 geradas sob condições de alto teor de NaCl apresentam um fenótipo altamente patogênico e estável, caracterizado pela liberação de citocinas pró-inflamatórias GM-CSF, TNF-alpha e IL-2 (6). Neste contexto, Sumida e colaboradores (7) buscaram entender o que poderia estar levando a disfuncionalidade das células Tregs em pacientes com EM, e em um microambiente inflamatório induzido por elevados níveis de NaCl. De fato, as células (CD4+CD25hiCD127lo-negCD45RO+ - Tregs de memória - mTreg) de pacientes com EM apresentam uma elevada expressão de IFN-g e uma redução de IL-10, e o mesmo perfil é observado em culturas suplementadas com NaCl ou estimuladas com anti-CD3 e anti-CD28. Por meio de análise computacional de RNAseq, foi possível observar que células mTreg IFN-g+ vs. mTreg IL-10+ apresentam perfil gênico distintos, entretanto ambas apresentam um regulador upstream comum: Beta-catenina. A via de sinalização Wnt-Beta-catenina está intimamente relacionada principalmente as células mTreg produtoras de IFN-g+. Além disso, a super-expressão Beta-catenina em células Tregs de camundongos levou a um fenótipo autoimune letal associado a um fenótipo de células Tregs disfuncional. Ainda, foi identificado que o receptor da prostaglandina E2 (PTGER2) é um regulador da produção de IFN-g e IL-10 sob um ambiente com alto teor de sal, com a ativação distorcida do eixo Beta-catenina-SGL1-FOXO, evidenciando o elo entre PTGER2- Beta-catenina em células Tregs, ligando condições ambientais de alto teor de sal e autoimunidade (7).
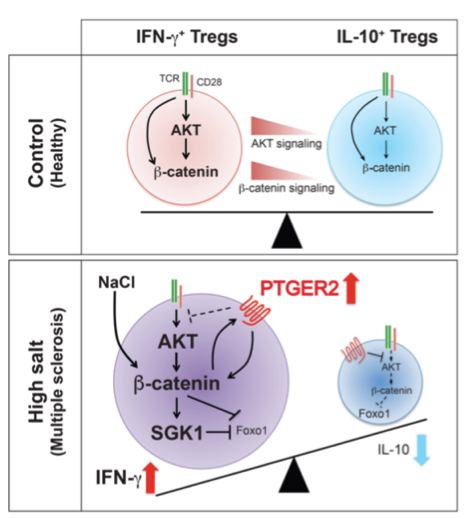
Figura 1. Modelo de ativação de células Tregs produtoras de IFN-g+ e IL-10+. Neste esquema é demonstrado o eixo de sinalização via PTGER2 e o eixo AKT- Beta-catenina-SGK1-Foxo1 para a produção de IFN-g+ e IL-10+ nas células Tregs. AKT- Beta-catenina leva ao balanço de IFN-g e IL-10. Entretanto em altas concentrações de NaCl, PTGER2 é aumentado levando a estabilização de um “loop” positivo com Beta-catenina, resultando na amplificação do eixo Beta-catenina-SGK1-Foxo para a produção de IFN-g pelas células Tregs.
Referências
- JOSEFOWICZ, S. Z.; LU, L.-F.; RUDENSKY, A. Y. Regulatory T cells: mechanisms of differentiation and function. Annual Review of Immunology, v. 30, p. 531–564, 2012.
- RUBTSOV, Y. P. et al. Regulatory T cell-derived interleukin-10 limits inflammation at environmental interfaces. Immunity, v. 28, n. 4, p. 546–558, abr. 2008.
- VIGNALI, D. A. A.; COLLISON, L. W.; WORKMAN, C. J. How regulatory T cells work. Nature Reviews. Immunology, v. 8, n. 7, p. 523–532, jul. 2008.
- DOMINGUEZ-VILLAR, M.; BAECHER-ALLAN, C. M.; HAFLER, D. A. Identification of T helper type 1-like, Foxp3+ regulatory T cells in human autoimmune disease. Nature Medicine, v. 17, n. 6, p. 673–675, jun. 2011.
- PALING, D. et al. Sodium accumulation is associated with disability and a progressive course in multiple sclerosis. Brain: A Journal of Neurology, v. 136, n. Pt 7, p. 2305–2317, jul. 2013.
- WU, C. et al. Induction of pathogenic TH17 cells by inducible salt-sensing kinase SGK1. Nature, v. 496, n. 7446, p. 513–517, 25 abr. 2013.
- SUMIDA, T. et al. Activated β-catenin in Foxp3+ regulatory T cells links inflammatory environments to autoimmunity. Nature Immunology, 29 out. 2018.

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










