Autores: Djúlio César Zanin e Priscila Côrrea
Editado por Daniela Carlos Sartori
Referência:
PARK, J. H. et al. Tumor hypoxia represses γδ T cell-mediated antitumor immunity against brain tumors. Nature Immunology, v. 22, p. 336-346, 2021. doi: 10.1038/s41590-020-00860-7
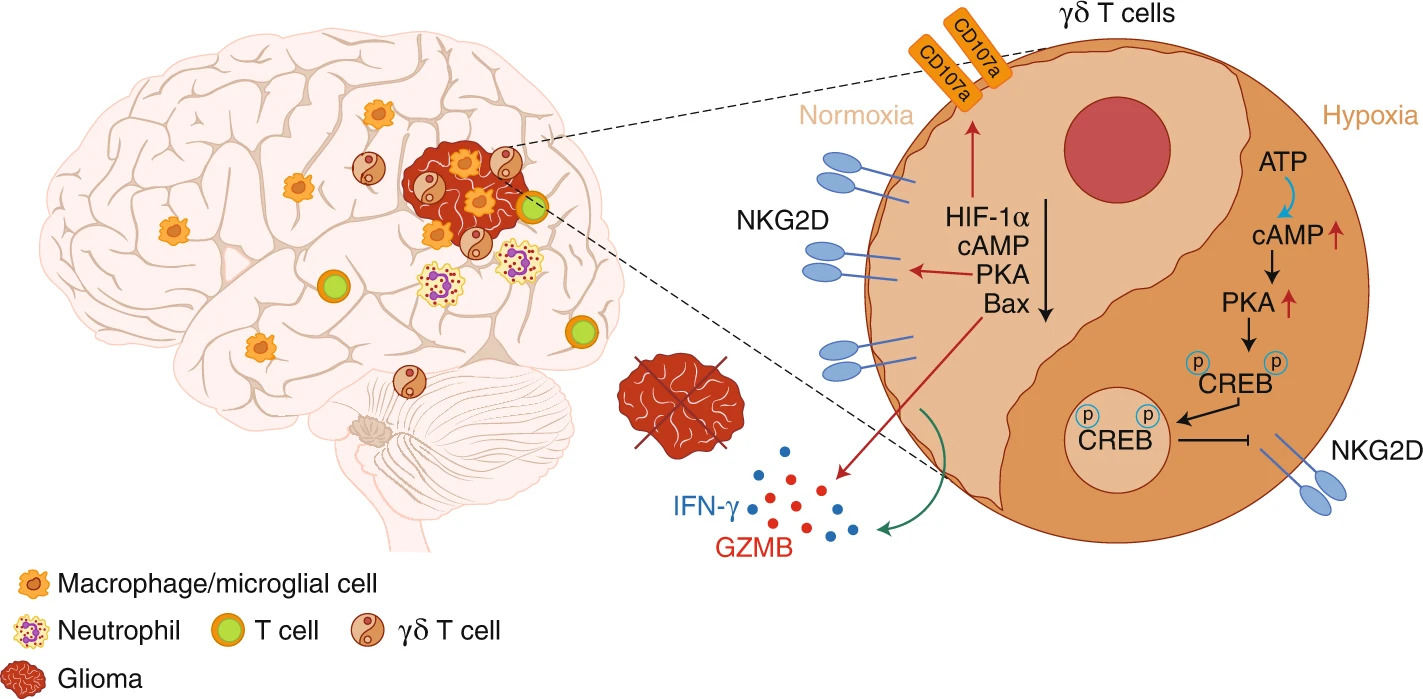
Tumores cerebrais malignos correspondem a uma pequena parcela dentre os diversos tipos de câncer, mas apresentam difícil diagnóstico e tratamento. A imunogenicidade dos tumores cerebrais é influenciada por fatores do microambiente, como a hipóxia, onde há a diminuição da disponibilidade de O2 pela alta taxa de proliferação das células tumorais. Com o objetivo de investigar os mecanismos pelos quais o microambiente tumoral hipóxico afetava a resposta anti-tumoral mediada por linfócitos T γδ, os estudos realizados por Park e colaboradores (2021), mostraram que o influxo de linfócitos T CD8+ e de T γδ era reduzido em modelo murino de glioma de alto grau, concomitantemente com a redução da expressão de CD107a (relacionado à citotoxicidade). Camundongos com deficiência de linfócitos T CD8+, T γδ, T CD4+ ou de células natural killer (NKs), não apresentavam melhora da sobrevida frente à indução de glioma, sugerindo a presença de um mecanismo de supressão ocasionado pelo microambiente tumoral.
Análises de transcrição gênica dos linfócitos infiltrantes no cérebro de animais com glioma, revelaram alta expressão de HIF1-α (fator 1-alfa induzido por hipóxia) e Bax (regulador apoptótico) nos linfócitos T γδ, evidenciando que estas células tinham efeito do processo de hipóxia e morte celular. Os autores também demonstraram que as taxas de consumo de O2 eram maiores em linhagens celulares de glioma quando comparadas a células de melanoma. De modo a reduzir a taxa respiratória das células tumorais, os animais receberam metformina (fármaco já conhecido no tratamento de diabetes do tipo 2, mas também com mecanismo de ação no complexo I da cadeia respiratória). A metformina atenuou a hipóxia, além de reduzir o tumor e elevar a sobrevivência de camundongos com glioma. A resposta anti-tumoral conferida pela metformina envolveu a indução da atividade funcional dos linfócitos T γδ e resultou em aumento de subpopulações produtoras de granzima B, IFN-γ e TNF, e que também expressavam CD107a e o receptor NKG2D. Linfócitos T γδ via NKG2D podem levar à morte das células tumorais, liberando granzimas e perforinas. Ao contrário dos linfócitos T CD4+ e T CD8+, os T γδ conseguem reconhecer diretamente moléculas induzidas por stress na célula tumoral via NKG2D. Assim, a melhora da hipóxia sensibilizou as células T γδ a combaterem o tumor por meio da citotoxicidade.
Já é conhecido que a expressão de HIF1-α em baixas concentrações de O2 ativa vias de sinalização relacionadas a uma variedade de efeitos biológicos. A regulação positiva de HIF-1α no câncer tem sido associada ao aumento da concentração intracelular de adenosina 3′5′-monofosfato cíclica, o cAMP, que por sua vez, afeta a atividade da proteína quinase A (PKA). PKA participa de vários processos celulares, como a ativação e a proliferação, e ao fosforilar outras proteínas influencia na expressão gênica, podendo induzir vias que afetam o funcionamento da célula. No artigo foi demonstrado que o tratamento de células de glioma com um análogo de cAMP, promovia o aumento da expressão de PKA e inibia NKG2D, sugerindo que a hipóxia altera a expressão deste receptor nos linfócitos T γδ via PKA.
A transferência adotiva de células T γδ pré-tratadas com um inibidor de HIF-1α, apresentou efeitos benéficos na sobrevivência de animais com glioma, comparáveis com a transferência de células tratadas com metformina. De forma promissora, os achados do trabalho (Figura 1) fornecem alternativas terapêuticas ao câncer cerebral, uma vez que imunoterapias que bloqueiam o fenótipo de exaustão de células T (como o uso de anticorpos monoclonais anti-PD-1), não apresentam benefícios em prolongar a sobrevida de pacientes neste tipo de câncer, sugerindo limitação da difusão do anticorpo no microambiente tumoral devido à barreira hematoencefálica.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










