Autores: Ualter Cipriano e Gabriel Victor L Silva
Editora: Beatriz R Ferreira
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada USP/RP.
Artigo: Pinho-Ribeiro, F.A., Deng, L., Neel, D.V. et al. Bacteria hijack a meningeal neuroimmune axis to facilitate brain invasion. Nature 615, 472–481 (2023). https://doi.org/10.1038/s41586-023-05753-x
A meningite é uma inflamação que ocorre em estruturas cerebrais chamadas meninges, que consistem em três membranas (dura, aracnoide e pia). Essas estruturas protegem o sistema nervoso central (SNC) de lesões e infecções, evitando assim que patógenos bacterianos possam invadir o cérebro e causar patologia grave (1). A meningite bacteriana aguda ocorre através da presença de microrganismos, principalmente na meninge dural, levando à inflamação, sendo o principal sintoma associado, a cefaleia (2). As meningites bacterianas agudas apresentam taxas de mortalidade de até 30%, e os sobreviventes geralmente apresentam sequelas neurológicas pós-infecciosas (2).
A sinalização de dor no SNC é feita através de neurônios nociceptores, que são neurônios somatossensoriais periféricos que detectam estímulos nocivos e prejudiciais, sinalizando através da produção de um neuropeptídeo chamado CGRP, que atua na sinapse gerando dor (3, 4). Os nociceptores podem se comunicar com a vasculatura e células imunológicas através de neuropeptídeos para induzir inflamação neurogênica ou imunomodulação (4). Diversas células do sistema imunológico, tanto da resposta inata quanto adaptativa residem nas meninges durais e desempenham funções no reparo tecidual, reconhecimento de antígenos e defesa do hospedeiro (5). No entanto, o impacto dos sinais neuronais nessas células de defesa do hospedeiro no momento da infecção bacteriana é pouco compreendido.
Assim, primeiramente os autores caracterizaram a presença de nociceptores que produzem o neurotransmissor CGRP nas meninges. Depois, utilizando um modelo de meningite bacteriana por inoculação intravenosa de bactérias do gênero Streptococcus sp. em camundongos, eles foram capazes de quantificar unidades formadoras de colônias (CFU) a partir da sexta hora após infecção na dura-máter e encontraram que após vinte e quatro horas essas bactérias já conseguiram invadir o cérebro.
Para confirmar a importância dos nociceptores na defesa do hospedeiro, os autores criaram camundongos deficientes para nociceptores e observaram que após o desafio com as bactérias, esses animais apresentaram menor número de CFU no SNC quando comparado aos controles no tempo de vinte e quatro horas após a infecção. Além disso, esses animais deficientes apresentaram um maior número absoluto de neutrófilos, monócitos, macrófagos e linfócitos T e B na dura-máter. Isto, os levou à primeira conclusão: as bactérias estão se aproveitando dos nociceptores para invadir o SNC.
Em seguida, eles demonstraram que as bactérias estão diretamente induzindo nociceptores a liberarem CGRP através da produção de toxinas. Além disso, quando animais deficientes para o receptor de CGRP (Ramp1) foram desafiados com as bactérias, eles mostraram um menor número de CFU nas meninges e cérebro, além de maior número de células imunológicas quando comparado aos controles. O que demonstra que o CGRP está atuando diretamente nas células imunológicas.
Ao realizarem sequenciamento de célula única em leucócitos presentes nas meninges observaram que macrófagos, neutrófilos e monócitos eram as células que mais expressavam Ramp1 (o receptor de CGRP). Experimentos de cultura celular demonstraram que esses macrófagos na presença de bactérias e CGRP, têm diminuída produção de quimiocinas importantes para atrair monócitos, neutrófilos e linfócitos quando comparados aos macrófagos infectados na ausência do neuropeptídeo.
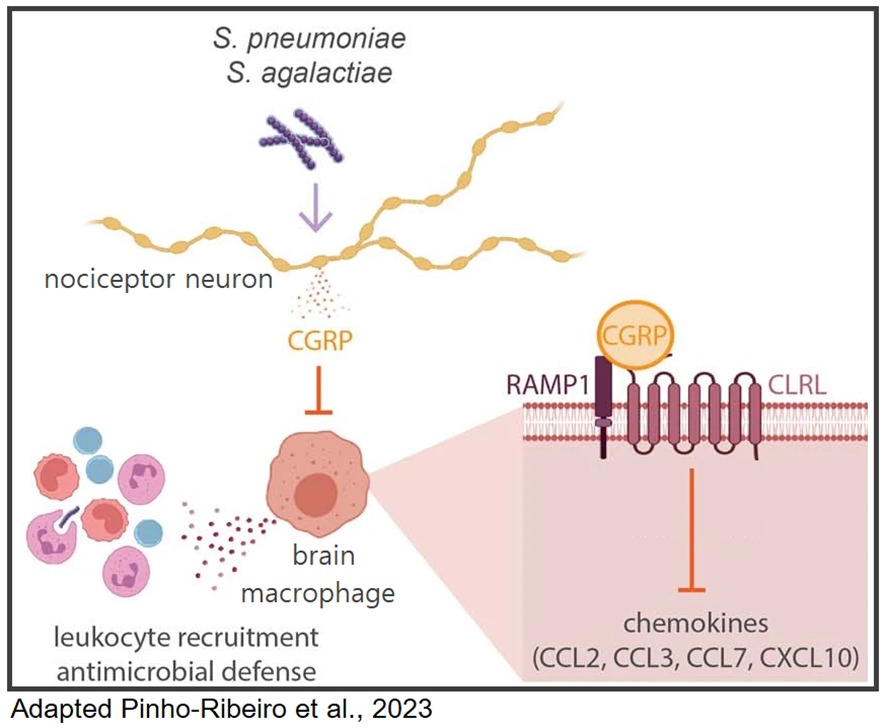
Em conclusão, os pesquisadores mostraram que durante uma infecção no SNC, bactérias interagem com neurônios nociceptores, ativando-os, que em resposta liberam neuropeptídeos CGRP. Em seguida, moléculas CGRP modulariam os macrófagos, inibindo a expressão e produção de quimiocinas que recrutariam outros leucócitos para realizarem a o controle das bactérias (Figura 1).
Figura 1. Resumo gráfico. Bactérias S. pneumoniae e S. agalactiae invadem as meninges ativando nociceptores para induzir a liberação de neuropeptídeo CGRP. O CGRP atua por meio de seu receptor Ramp1 nos macrófagos meníngeos, diminuindo a expressão de quimiocinas de forma a suprimir o recrutamento de leucócitos e as defesas antimicrobianas. A ablação de nociceptores ou o bloqueio da sinalização do CGRP aumenta a defesa do hospedeiro contra a meningite.
Referências:
- Levy, D., Labastida-Ramirez, A. & MaassenVanDenBrink, A. Current understanding of meningeal and cerebral vascular function underlying migraine headache. Cephalalgia 39, 1606–1622 (2019).
- van de Beek, D. et al. Clinical features and prognostic factors in adults with bacterial meningitis. N. Engl. J. Med. 351, 1849–1859 (2004).
- Basbaum, A. I., Bautista, D. M., Scherrer, G. & Julius, D. Cellular and molecular mechanisms of pain. Cell 139, 267–284 (2009).
- Pinho-Ribeiro, F. A., Verri, W. A. Jr. & Chiu, I. M. Nociceptor sensory neuron-immune interactions in pain and inflammation. Trends Immunol. 38, 5–19 (2017).
- Rustenhoven, J. et al. Functional characterization of the dural sinuses as a neuroimmune interface. Cell 184, 1000–1016.e27 (2021).
- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)