Autores: Rafaela Miranda Barbosa e Ualter Cipriano
Editora: Profa Vanessa Carregaro
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada USP/RP
As células natural killer (NK) são linfócitos da imunidade inata responsáveis por respostas imunológicas rápidas desde fase inicias das infecções, até a geração de linfócitos TCD4 e TCD8 específicos contra o patógeno invasor. As células NK são encontradas de forma heterogênea no corpo humano, estando mais presentes em órgãos como baço, fígado e pulmão. A disposição dessas células na pele varia de indivíduo para indivíduo. Acredita-se que essa disposição seja devido à variação em infecções dérmicas, onde a ocorrência leva ao recrutamento e persistência dessas células, mantendo-as como residentes no sítio infeccioso. Dessa maneira, surge a hipótese de que células NK podem migrar para um tecido e estabelecerem residência.
O estudo recentemente publicado por Torcellan e colaboradores, intitulado de “Circulating NK cells establish tissue residency upon acute infection of skin and mediate accelerated effector responses to secondary infection”, busca verificar a presença de células NK em tecidos saudáveis. Em experimentos com modelos de infecções locais na pele, foi observado um aumento significativo das células NK circulantes (cNK) no local da infecção, com essas células persistindo por várias semanas. Ainda, foi confirmado que infecções sistêmicas não induzem o aumento indireto dessas células, sugerindo que há um mecanismo localizado e específico de resposta à infecção.
Avançando no estudo, por meio do sequenciamento gênico de células únicas, análises de expressão genica encontraram dois principais subtipos de células NK exclusivas da pele: um grupo com características de cNK (Eomes+CD49a-CD49bhiCD69lowTcf1low) e outro de células NK com aspectos fenotípicos de residência em tecido, chamadas de células NK residentes de tecido (trNK) (Eomes+CD49a-CD49blowCD69hiTcf1hi). O primeiro grupo exibiu aumento de proteínas de superfície associadas à ativação celular, indicando capacidade citotóxica aumentada, enquanto o segundo grupo mostrou marcadores de residência tecidual elevados e baixos níveis de proteínas relacionadas à ativação celular e maturação, sugerindo que essas células são as que de fato persistem por várias semanas após a infecção local na pele.
Para determinar a origem das trNK da pele, foram realizados experimentos de rastreio e confirmaram que as cNK eram, de fato, as precursoras das trNK na pele, e também eram as principais produtoras de IFN-γ, ou seja, as células cNK entravam na pele e diferenciavam-se em dois perfis: as cNKs mais ativadas e com funções efetoras (i.e. produção de IFN-γ), e as trNK expressando marcadores de ativação reduzidos, além da expressão sustentada de Tcf1 (codificado por Tcf7) e altos índices de residência no tecido.
Por fim, os experimentos mostraram que, durante a reinfecção, as trNK não só aumentam a produção de IFN-γ, mas também passam por uma reconfiguração rápida, diminuindo Tcf1 e aumentando marcadores de citotoxicidade e ativação celular, como Grmb, CD137, CD25, Ilt3, Sca-1 e Prf1. Esse cenário favorece a plasticidade das trNK, permitindo uma resposta efetora rápida e robusta à reinfecções.
Em suma, este estudo elegante mostrou a origem e a plasticidade que as células NK na pele, gerando evidências sólidas de como elas se adaptam e se transformam em resposta a infecções.
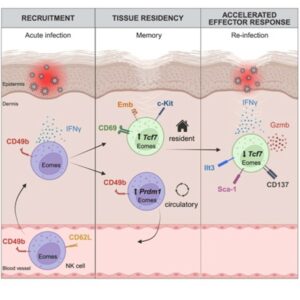
Figura 1 - Durante uma infecção aguda na pele, células NK convencionais (cNK) expressando Eomes, CD49b e CD62L são recrutadas para o local da infecção. Neste ambiente, parte das cNK pode seguir um caminho de diferenciação terminal, com aumento da expressão de Prdm1 e adquirir características efetoras determinadas pelo aumento de genes e moléculas de ativação e citotoxicidade. Paralelamente, uma fração das cNK no local da infecção passa por uma transformação, guiada pela perda da expressão de CD49b e aumento de marcadores típicos de células residentes de longa duração, como Emb, c-Kit e, principalmente, CD69 — sendo este último, o principal indicador dessas células. Além disso, o aumento da expressão de Tcf7 (que codifica Tcf1) nessas células contribui para prevenir a diferenciação terminal, favorecendo a persistência dessas células trNK na pele mesmo por várias semanas após a erradicação do agente infeccioso. No processo de reinfecção, essas células trNK exibem uma nova fase de plasticidade acompanhada de uma resposta efetora acelerada. Nesse contexto, há diminuição na expressão de Tcf1 seguida da produção aumentada de IFN-γ e nos níveis de mediadores de citotoxicidade, como granzima B e perforina, além da elevação dos marcadores de ativação celular, incluindo CD137, Ilt3 e Sca-1.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)