Autores: Caroline Vitória de Oliveira e Samuel Alves
Editora: Daniela Carlos Sartori
Seminário apresentado na disciplina Tópicos Avançados de Imunologia do Programa de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP
Dados da Organização Mundial da Saúde estimam que até julho de 2023 o vírus da imunodeficiência humana (HIV) foi responsável por dizimar mais de 40 milhões de vidas, sendo que sua transmissão ocorre à nível mundial. Foi estimado, também, que 39 milhões de pessoas viveram com HIV até o final de 2022, sendo mais de 2/3 dessas pessoas nas regiões do continente africano 1.
Considerando não somente o impacto epidemiológico, mas também a gravidade que a infecção pelo HIV pode tomar na qualidade da vida das pessoas que foram infectados – já que, se não tratado, pode chegar a seu estágio mais avançado, a AIDS –. O trabalho intitulado “The CARD8 inflammasome dictates HIV/SIV pathogenesis and disease progression”, publicado na revista Cell no final de fevereiro de 2024, tem como objetivo estreitar o espaço desconhecido entre a infecção pelo HIV (e SIV em primatas não humanos) e o desenvolvimento da doença AIDS, que tem como principal característica a súbita queda na contagem de células T CD4+ 1.
Os autores demonstram neste estudo a rápida morte de células T CD4 de humanos após a infecção com vírus HIV. Esta morte celular ocorre mesmo em células tratadas com drogas que inibem a integração do material genético do vírus no genoma da célula hospedeira e a replicação viral, mas é bloqueada em células tratadas com fármacos que bloqueiam a entrada viral ou a sua protease viral. Estes achados indicam que o vírus precisa entrar na célula T para induzir uma morte rápida, a transcrição reversa e a integração ao genoma são dispensáveis neste processo, enquanto a protease viral é um elemento chave.
A infecção das células T CD4 com um lentivirus carreando a protease viral foi suficiente para promover os mesmos efeitos do HIV WT, os quais foram totalmente bloqueados em células CARD8 KO. A protease viral é detectada pelo CARD8 da célula hospedeira, que é rapidamente ativado e promove a piroptose da célula infectada e subsequente liberação de IL-1 β. Já as células T CD4 deficientes de CARD8 são resistentes a rápida morte induzida pelo vírus WT, bem como células T CD4 WT são resistentes a infecção pelo HIV mutante que não expressa a protease viral. Em ambos os casos, a morte celular é reduzida e consequentemente a viabilidade aumentada, bem como marcadores de ativação de inflamassoma são reduzidos, como a clivagem de gasdermina D (GSDMD), clivagem de caspase –1 (CASP1) e liberação de IL-1β.
Algumas espécies de primatas não humanos (PNH) podem ser infectadas por um vírus da imunodeficiência (Vírus da Imunodeficiência Símia - SIV) e conviver harmonicamente com o vírus, enquanto outras espécies de PNH podem desenvolver AIDS, assim como os humanos infectados pelo HIV. Ao se comparar os genomas destes animais, observou-se a presença de CARD8 em todos eles, no entanto, os PNH que não desenvolviam AIDS (hospedeiros naturais) possuíam uma série de mutações no domínio efetor do CARD8, o que levou a hipótese de que a funcionalidade do CARD8 é o fator central na patogênese da AIDS. A hipótese foi confirmada ao se observar que a linhagem celular THP1 expressando o CARD8 mutado, presente em hospedeiros naturais, é incapaz de recrutar e clivar CASP1, IL-1β e GSDMD, enquanto as células expressando o CARD8 intacto presente em hospedeiros não naturais fazem o processo de clivagem de CASP1, GSDMD e liberação de IL-1β. Além disso, células T CD4 oriundas de hospedeiros naturais são resistentes à morte induzida pelo SIV, enquanto a aquelas oriundas de hospedeiros não naturais rapidamente entram em piroptose.
Em ambos os grupos de animais, os hospedeiros naturais e os não naturais, estratégias diferentes foram selecionadas evolutivamente, o que provavelmente se deve as diferentes pressões seletivas que agiram sobre os grupos separados geograficamente, após a migração dos respondedores para a Ásia e a permanência dos tolerantes na África, cerca de 11 milhões de anos atrás. É importante ressaltar que ambos os grupos tiveram excelente sucesso evolutivo e estão presentes no planeta até hoje, ou seja, não podemos dizer que uma estratégia é mais vantajosa que a outra. É possível ainda que o CARD8 disfuncional possa dificultar a resposta de hospedeiros naturais do SIV contra outros patógenos, o que não seria um problema para os hospedeiros não naturais, os quais possuem um CARD8 funcional e poderiam lidar facilmente com uma infecção na qual este inflamassoma tenha um papel protetor.
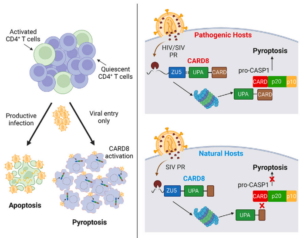
Figura resumo:
Fig 1. Resumo esquemático: Células T CD4 ativadas, quando infectadas pelo HIV ou SIV, funcionam como um ótimo nicho para a replicação viral, a alta quantidade de partículas virais promove a morte apoptóticas destas células. Por sua vez, células naive e de memória morrem por piroptose de modo imediato a entrada do vírus. Nos hospedeiros suscetíveis à infecção, o CARD 8 funcional, ativado inicialmente pela protease viral e posteriormente pela ação do proteassoma, promove a piroptose do linfócito infectado. Já nos hospedeiros que não desenvolvem imunodeficiência, o CARD8 possui multações em seu domínio CARD, o que inviabiliza o recrutamento de pró-caspase-1 e a consequente morte piroptótica, assim, a Célula T CD4 sobrevive a infecção e os animais não adoecem, embora apresentem alta carga viral.
Referência:
- World Health Organization (WHO), July 13th 2023, HIV and AIDS, accessed at June 11th 2024: https://www.who.int/news-room/fact-sheets/detail/hiv-aids;



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)