Autores: Christian Ferreira Alves e Samuel Oliveira
Editor: Ademilson Panunto Castelo
Seminário apresentado na disciplina Tópicos Avançados de Imunologia do Programa de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
No estudo intitulado “Nucleophosmin 1 promotes mucosal immunity by supporting mitochondrial oxidative phosphorylation and ILC3 activity” publicado na revista Nature Immunology, Zhao e colaboradores evidenciaram o papel crucial da nucleofosmina 1 (NPM1) na expansão e função das ILC3s durante a colite. NPM1 interage diretamente com a subunidade p65 do fator de transcrição nuclear kappa B (NF-κB) o que induz a homeostase intestinal por induzir a biogênese mitocondrial e a produção de interleucina (IL-) 22.
As doenças inflamatórias intestinais são um grave problema de saúde pública em todo o mundo. A colite ulcerativa (UC) é a manifestação mais comum dessas doenças, tendo sua etiologia uma natureza multifatorial. Além de todos os transtornos diretos causado pela irritação persistente do cólon, a UC consiste em um importante fator de risco para o desenvolvimento de câncer colorretal associado à colite (CAC).
Uma gama enorme de células do sistema imunológico tem relevância na colite, tanto no agravamento, como na proteção. Células com perfis pró-inflamatórios, tais como as T auxiliadoras do tipo 1 (Th1) e Th17, podem ser patogênicas, enquanto células T reguladoras (Treg) tem papel protetor. No que tange a imunidade inata, as ILC3 vem sendo bastante estudadas no contexto da colite devido ao seu papel dúbio, podendo ser benéficas, ao produzir principalmente níveis ótimos de IL-22, IL-17 e IL-1β, citocinas importantes na manutenção da barreira intestinal, mas também podendo ser deletérias ao produzir grandes quantidades de IL-17 e interferon (IFN-) γ e promover o agravamento da inflamação.
A NPM1 é uma proteína da família das chaperonas de histona com capacidade de promover biogênese ribossômica, modelamento de histonas e de se ligar ao DNA, e altamente expressa em uma grande quantidade de tumores sólidos, inclusive os tumores de cólon, estando associada à sua progressão. Até então, não existiam evidências de um papel da NPM1 em células do sistema imunológico no combate ao CAC e na prevenção da UC. Como estas duas doenças estão intimamente associadas, os autores formularam a hipótese de que o NPM1 possa ser um regulador mestre da homeostase intestinal, ao regular a expressão de IL-22 em ILC3, principal célula fonte dessa citocina no intestino.
Os autores identificaram uma redução da expressão de NPM1 no cólon de pacientes com UC em comparação com indivíduos saudáveis. Em animais deficientes em NPM1 nos quais se induziu colite por sulfato de dextrana (DSS), houve uma maior perda de massa corporal, encurtamento do cólon e aumento da expressão de marcadores inflamatórios quando comparado aos animais suficientes para esse gene. Considerando-se o risco elevado do desenvolvimento de CAC em pacientes com doenças inflamatórias intestinais, investigou-se o papel da NPM1 na tumorigênese do cólon. A deficiência de NPM1 resultou em um maior número de tumores induzidos por azoximetano, sugerindo um papel protetor da NPM1 na colite e na prevenção do câncer de cólon.
Ao se avaliar as células reguladas por NPM1 na inflamação intestinal, foi mostrado que havia uma diminuição das ILC3s, particularmente as ILC3s que produzem IL-22, no cólon dos animais deficientes de NPM1 comparados aos controles suficientes para o gene. Elegantemente, os autores fizeram ensaios com camundongos com deleção condicional do gene de NPM1 em ILC3s e mostraram que esses animais exibiam maior suscetibilidade à colite induzida por DSS quando comparado aos animais controles. Esses resultados sugerem fortemente que a expressão de NPM1 em ILC3 é essencial para a homeostase intestinal em condições de lesão.
Análises de RNA-seq em ILC3s de camundongos WT (Npm1+/+) e Npm1⁺/⁻ com colite induzida mostraram redução de genes envolvidos na fosforilação oxidativa em Npm1⁺/⁻, correlacionando-se com diminuição do metabolismo e número de mitocôndrias nessas células. Experimentos in vitro demonstraram que NPM1 se liga à subunidade p65 do NF-κB para regular o fator de transcrição mitocondrial A (TFAM), que é essencial para a biogênese e função mitocondrial em ILC3s. Além disso, os pesquisadores mostraram que a superexpressão de NPM1 em Npm1⁺/⁻ conferia proteção contra a colite induzida.
Esses achados destacam o papel crucial de NPM1 na expansão e função das ILC3s durante a colite induzida por DSS, sendo necessária sua interação com a subunidade p65 do NF-κB para promover a transcrição de TFAM, o que regula a biogênese mitocondrial e mantem a produção de IL-22, fundamentais para a homeostase intestinal. Este estudo fornece insights sobre a conexão entre doenças inflamatórias intestinais e o processo de tumorigênese do cólon.
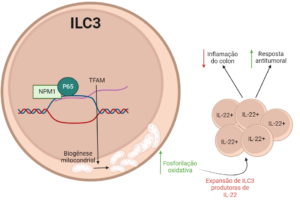
Figura resumo: NPM1 interage com p65 e regula a transcrição do fator de TFAM, desempenhando um papel essencial na manutenção da biogênese mitocondrial e da fosforilação oxidativa (OXPHOS), promovendo proteção contra doenças inflamatórias intestinais e contra o CAC.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










