Autoras: Bruna Manuella S. Silva e Keise Adrielle S. Pereira
Editor: Ademilson Panunto Castelo
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP
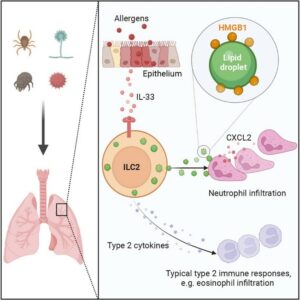
Em um estudo intitulado “Alarmin-loaded extracellular lipid droplets induce airway neutrophil infiltration during type 2 inflammation”, publicado no períódico Immunity, em novembro de 2024, Zebing Rao1 e cols. identificaram um novo mecanismo pelo qual as células linfoides inatas tipo 2 (ILC2s) contribuem para o acúmulo de neutrófilos na inflamação alérgica das vias aéreas. Mostraram que as ILC2s liberam gotículas lipídicas (GLs) carregadas com a proteína HMGB1 (do inglês, “High Mobility Group Box-1”), que promove a quimiotaxia dos neutrófilos. Vale salientar que nesse trabalho é descrita uma via de entrega intercelular previamente desconhecida de sinalização de alarmina mediada por GLs extracelulares, o que permite que ILC2s desencadeiem infiltração de neutrófilos nesse tipo de inflamação alérgica.
As doenças alérgicas respiratórias vêm aumentado a cada ano, representando um grave problema econômico e de saúde pública.2,3 Investigações recentes têm mostrado que ILC2s tem um papel fundamental na fisiopatologia da inflamação alérgica.4 As ILC2s podem ser ativadas por diversos mediadores, devido ao seu amplo repertório de receptores, como as alarminas IL-33 e IL-25, além de neuropeptídeos. Durante a inflamação, lesões teciduais liberam esses mediadores, que ativam as ILC2s, levando à produção rápida de citocinas do tipo 2, tais como IL-4, IL-5 e IL-13. Essas citocinas promovem respostas inflamatórias em diferentes tipos de células adjacentes.5,6 Como esperado, tais citocinas induzem migração de eosinófilos, no entanto, estudos relatam a presença de neutrófilos nas vias aéreas de pacientes com asma grave e em modelos experimentais de inflamação alérgica,7,8 sendo desconhecido o mecanismo pelo qual as ILC2s regulam a infiltração de neutrófilos nas vias aéreas durante a inflamação.
Para investigar esse fenômeno, os pesquisadores utilizaram linhagens de camundongos geneticamente modificadas que eram destituídas de ILCs, induzindo-se inflamação alérgica por administração intranasal de IL-33. Diferente do que acontecia em camundongos “normais” (WT), os quais apresentavam um aumento significativo de neutrófilos no líquido de lavagem broncoalveolar (BALF), os camundongos desprovidos de linfócitos T e B e ILCs não apresentaram tal resposta. Quando esses camundongos desprovidos linfócitos e de ILCs receberam a transferência adotiva de ILC2s antes do tratamento com IL-33, passaram a apresentar a infiltração de neutrófilos no BALF após esse estímulo. Além disso, a administração do sobrenadante de ILC2s ativadas diretamente no trato respiratório induziu a migração de neutrófilos, reforçando o papel dessas células no processo inflamatório.
Outro experimento revelou que o sobrenadante de ILC2s ativadas com IL-33 induzia a quimiotaxia de neutrófilos em ensaios de migração transwell. Quando o sobrenadante foi tratado com proteinase K, a atividade quimiotática foi completamente bloqueada, indicando que proteínas secretadas pelas ILC2s eram responsáveis pelo recrutamento. Análises do sobrenadante identificaram o HMGB1 como uma proteína-chave com alta atividade quimiotática. Estudos in vitro e in vivo mostraram que o HMGB1 ativa neutrófilos, induzindo a expressão de CXCL2, uma quimiocina que amplifica o recrutamento neutrofílico.
Para investigar o papel do HMGB1, camundongos Hmgb1flox/flox foram cruzados com animais Cre específicos para ILC2s, criando linhagens com ILC2s deficientes em HMGB1. Em camundongos desafiados com IL-33, a ausência de HMGB1 em ILC2s reduziu significativamente a infiltração de neutrófilos no BALF e a inflamação tecidual nos bronquíolos, além de diminuir os níveis de CXCL2. Esses resultados destacam o HMGB1 como um mediador essencial para a amplificação da resposta inflamatória.
Os pesquisadores também exploraram o papel das GLs na secreção de HMGB1. ILC2s ativadas com IL-33 exibiram um aumento significativo na formação de GLs, que estavam diretamente associadas à secreção de HMGB1. Em camundongos deficientes no gene Hilpda, responsável pela formação de GLs, observou-se uma redução marcante na secreção de HMGB1 e na infiltração de neutrófilos. Esses achados indicam que as GLs são essenciais para o transporte e liberação de HMGB1 no ambiente inflamatório.
Análises proteômicas mostraram que o HMGB1 se associa à superfície das GLs e ensaios de quimiotaxia confirmaram que o sobrenadante contendo GLs carregadas com HMGB1 tem alta capacidade de atrair neutrófilos. Além disso, GLs extracelulares foram detectadas no BALF de camundongos com inflamação alérgica induzida por IL-33.
Em suma, o estudo revelou que as ILC2s desempenham um papel central na inflamação alérgica ao liberar GLs carregadas com HMGB1, promovendo a quimiotaxia e ativação de neutrófilos (Figura 1). Esses achados destacam as GLs como plataformas essenciais para a sinalização imunológica, apontando para novos alvos terapêuticos no manejo de doenças respiratórias alérgicas, como a asma.
Figura 1. Alérgenos inalados interagem com o epitélio das vias aéreas, induzindo a liberação de IL-33, uma alarmina que ativa as ILC2s residentes. Além de secretar citocinas do tipo 2, como IL-5 e IL-13, o que promove a infiltração de eosinófilos, as ILC2s acumulam e liberam gotículas lipídicas contendo HMGB1, uma proteína que estimula a produção de CXCL2, levando ao recrutamento e infiltração de neutrófilos no tecido pulmonar. Esse processo contribui para a resposta inflamatória exacerbada observada em condições alérgicas, como a asma.
Referências
- Rao Z, Liu S, Li Z, Wang Q, Gao F, Peng H, Ren D, Zang Y, Li H, Li Y, Hu Q, He D, Xu H. Alarmin-loaded extracellular lipid droplets induce airway neutrophil infiltration during type 2 inflammation. Immunity. 2024 Nov 12;57(11):2514-2529.e7. doi: 10.1016/j.immuni.2024.09.001.
- Porsbjerg C, Melén E, Lehtimäki L, Shaw D. (2023). Asthma. Lancet 401, 858–873. https://doi.org/10.1016/S0140-6736(22)02125-0.
- Holgate, S.T., Wenzel, S., Postma, D.S., Weiss, S.T., Renz, H., and Sly, P.D. (2015). Asthma. Nat. Rev. Dis. Primers 1, 15025. https://doi.org/10. 1038/nrdp.2015.25.
- Vivier, E., Artis, D., Colonna, M., Diefenbach, A., Di Santo, J.P., Eberl, G., Koyasu, S., Locksley, R.M., McKenzie, A.N.J., Mebius, R.E., et al. (2018). Innate lymphoid cells: 10 years on. Cell 174, 1054–1066. https://doi.org/ 10.1016/j.cell.2018.07.017.
- Rodriguez-Rodriguez, N., Gogoi, M., and McKenzie, A.N.J. (2021). Group 2 innate lymphoid cells: team players in regulating asthma. Annu. Rev. Immunol. 39, 167–198. https://doi.org/10.1146/annurev-immunol 110119-091711.
- Nussbaum, J.C., Van Dyken, S.J., von Moltke, J.,Cheng, L.E., Mohapatra, A., Molofsky, A.B., Thornton, E.E., Krummel, M.F., Chawla, A., Liang, H.E., et al. (2013). Type 2 innate lymphoid cells control eosinophil homeostasis. Nature 502, 245–248. https://doi.org/10.1038/nature12526.
- Kim, H.Y., DeKruyff, R.H., and Umetsu, D.T. (2010). The many paths to asthma: phenotype shaped by innate and adaptive immunity. Nat. Immunol. 11, 577–584. https://doi.org/10.1038/ni.1892.
- Radermecker, C., Louis, R., Bureau, F., and Marichal, T. (2018). Role of neutrophils in allergic asthma. 54, 28-34. doi: 10.1016/j.coi.2018.05.006.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)