Autoras: Maísa Leandro e Bruna Manuella
Editora: Profa Vanessa Carregaro Pereira
Disciplina: Tópicos Avançados em Imunologia- Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
Um estudo intitulado “Rorγt-positive dendritic cells are required for the induction of peripheral regulatory T cells in response to oral antigens”, publicado no periódico Cell em maio de 2025 por Rodrigues e colaboradores1, demonstrou como as células dendríticas (DCs) RORγt positivas são capazes de induzir células T reguladoras periféricas (pTreg) intestinais em resposta a antígenos orais.
O sistema imunológico é capaz de manter a tolerância a antígenos inofensivos em superfícies constantemente expostas ao ambiente externo, como a mucosa intestinal. As células T reguladoras periféricas (pTregs) exercem um papel central na manutenção dessa tolerância. Estudos anteriores identificaram uma subpopulação de células T reguladoras que expressam o fator de transcrição RORγt como responsável pela manutenção do ambiente tolerogênico no intestino2. No entanto, as células apresentadoras de antígenos (APCs) envolvidas na indução dessas pTregs intestinais permaneciam pouco caracterizadas.
Evidências mais recentes indicam que a indução de pTregs no intestino depende de células apresentadoras de antígenos (APCs) que também expressam RORγt, incluindo células linfoides inatas do tipo 3 (ILC3s) e duas subpopulações mais raras recentemente descritas: as células Thetis (TCs) e as células Janus (JCs)3-5. Com o objetivo de investigar o papel das APCs RORγt⁺ na indução de pTregs em resposta a antígenos orais, Rodrigues e colaboradores desenvolveram uma linhagem de camundongos com deleção seletiva de RORγt em APCs (denominados RorcE +7kbΔ/Δ), permitindo a análise funcional dessas APCs sem interferir na expressão de Rorc em linfócitos T. Apesar da preservação da expressão de RORγt nas células T, os autores observaram que os camundongos RorcE +7kbΔ/Δ apresentavam redução na frequência de pTregs e aumento na população de células Th2 intestinais. Esse desequilíbrio foi associado a um quadro de inflamação intestinal de baixo grau, sugerindo que a ausência de RORγt em APCs compromete a homeostase intestinal, afetando negativamente o balanço entre Tregs e Th2.
Como esse desequilíbrio imunológico poderia ser consequência de respostas disfuncionais à microbiota ou a antígenos alimentares, os autores investigaram ambas as possibilidades. A manipulação da microbiota não foi capaz de reverter o desvio Th2, sugerindo que o comprometimento da tolerância intestinal decorre, provavelmente, de uma resposta inflamatória exacerbada a antígenos alimentares. Para testar essa hipótese, foi utilizado um modelo de inflamação pulmonar alérgica, no qual a exposição oral ao antígeno antes da sensibilização induz tolerância mediada por pTregs e reduz a inflamação. Nesse modelo, os camundongos RorcE +7kbΔ/Δ falharam em estabelecer tolerância oral e apresentaram aumento na resposta Th2 pulmonar, reforçando a importância das APCs RORγt⁺ na indução da tolerância oral.
Visto que estudos anteriores atribuíram às APCs RORγt⁺ (como ILC3s, TCs e JCs) um papel na indução de pTregs, foi analisado se os camundongos RorcE +7kbΔ/Δ apresentavam defeitos na expressão de RORγt⁺ não somente nas ILC3, mas também nas JC e TCs. Através de uma análise de scRNA-seq de DCs intestinais e de linfonodos mesentéricos, foram identificados quatro clusters distintos de DCs RORγt⁺. Análises posteriores de predição celular indicaram que esses clusters correspondem aos subconjuntos TC I (JCs), TC II, TC III e TC IV, validando a identidade dessas APCs como TCs e JCs. Os camundongos RorcE +7kbΔ/Δ exibiram redução significativa de DCs RORγt⁺ (especialmente subtipos II–IV) e ILC3s, sem alterações nas JCs. Para avaliar a contribuição específica das ILC3s para o fenótipo observado, os autores geraram um modelo de camundongo com deleção seletiva de Rorc em ILC3s, preservando as DCs RORγt⁺. Surpreendentemente, a ausência de ILC3s não impactou a frequência de pTregs nem a expansão de células Th2, indicando que o fenótipo dos camundongos RorcE +7kbΔ/Δ não é consequência da perda de ILC3s.
Em conjunto, os dados de Rodrigues e colaboradores indicam que as DCs RORγt⁺, e não as ILC3s, são essenciais para a indução de pTregs intestinais e a prevenção de respostas Th2 exacerbadas frente a antígenos dietéticos, revelando um papel fundamental e previamente subestimado das DCs RORγt⁺ na manutenção da homeostase intestinal.
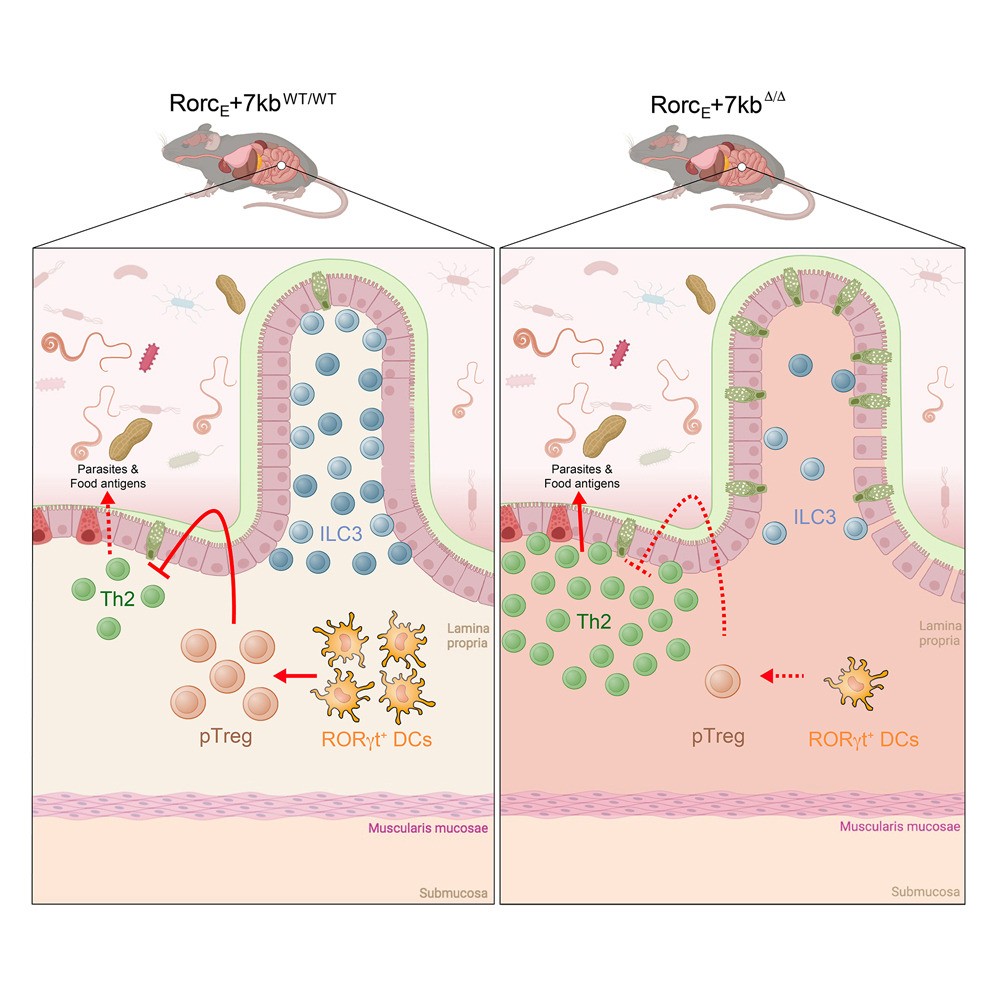 Fig. 1: Em condições normais (à esquerda, camundongol RorcE +7kbWT/WT), DCs RORγt⁺ promovem a diferenciação de pTregs em resposta a antígenos alimentares, favorecendo o equilíbrio Treg/Th2 e sustentando um ambiente intestinal tolerogênico. Na ausência de RORγt⁺ em DCs (à direita, camundongo RorcE +7kbΔ/Δ), a indução de pTregs é prejudicada, resultando em um aumento de células Th2, inflamação de baixo grau e falha na manutenção da tolerância oral.
Fig. 1: Em condições normais (à esquerda, camundongol RorcE +7kbWT/WT), DCs RORγt⁺ promovem a diferenciação de pTregs em resposta a antígenos alimentares, favorecendo o equilíbrio Treg/Th2 e sustentando um ambiente intestinal tolerogênico. Na ausência de RORγt⁺ em DCs (à direita, camundongo RorcE +7kbΔ/Δ), a indução de pTregs é prejudicada, resultando em um aumento de células Th2, inflamação de baixo grau e falha na manutenção da tolerância oral.
Referências
- Rodrigues PF, Wu S, Trsan T, et al. Rorγt-positive dendritic cells are required for the induction of peripheral regulatory T cells in response to oral antigens. Cell. 2025;188(10):2720-2737.e22. doi:10.1016/j.cell.2025.03.020
- Yang BH, Hagemann S, Mamareli P, et al. Foxp3(+) T cells expressing RORγt represent a stable regulatory T-cell effector lineage with enhanced suppressive capacity during intestinal inflammation. Mucosal Immunol. 2016;9(2):444-457. doi:10.1038/mi.2015.74
- Lyu M, Suzuki H, Kang L, et al. ILC3s select microbiota-specific regulatory T cells to establish tolerance in the gut. Nature. 2022;610(7933):744-751. doi:10.1038/s41586-022-05141-x
- Akagbosu B, Tayyebi Z, Shibu G, et al. Novel antigen-presenting cell imparts Treg-dependent tolerance to gut microbiota. Nature. 2022;610(7933):752-760. doi:10.1038/s41586-022-05309-5
- Kedmi, Ranit et al. “A RORγt+cell instructs gut microbiota-specific Treg cell differentiation.” Nature 610,7933 (2022): 737-743. doi:10.1038/s41586-022-05089-y



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










