Autoras: Maísa Leandro e Gabriélly Trindade
Editor: Prof. Dr. Ademilson Panunto Castelo
Seminário apresentado na disciplina Tópicos Avançados de Imunologia do Programa de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
Recentemente, foi publicado no periódico Nature Immunology o estudo intitulado “Aberrant T follicular helper cells generated by TH17 cell plasticity in the gut promote extraintestinal autoimmunity”, no qual Tingting Fan e colaboradores exploraram e caracterizaram o papel das células T auxiliares foliculares 17 no contexto de doenças autoimunes.[1]
Os linfócitos T auxiliares foliculares (TFH) são especializados em cooperar com linfócitos B nos centros germinativos (CG). Sabe-se que as células TFH constituem uma população heterogênea, podendo ser classificadas em subpopulações, como TFH1, TFH2 e TFH17. Este último subtipo, em particular, tem sido associado a doenças autoimunes, como a artrite reumatoide (AR), e parece contribuir para a produção excessiva de autoanticorpos.[2] As TFH17 foram descritas como derivadas da linhagem TH17 nas placas de Peyer (PPs), apresentando potencial para migrar para sítios sistêmicos.[3] Contudo, os mecanismos que promovem essa plasticidade, a migração e o impacto dessas células no desenvolvimento de doenças autoimunes ainda são pouco conhecidos.
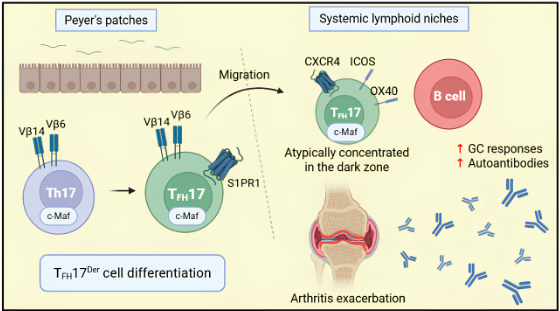
Para investigar o papel das TFH17 no contexto da AR, os autores utilizaram camundongos K/BxN, que desenvolvem espontaneamente essa doença. Nesse modelo, a microbiota intestinal exerce um impacto significativo, sendo a colonização por bactérias filamentosas segmentadas (SFB) um fator determinante para o desenvolvimento da patologia. Os autores observaram que animais colonizados com SFB apresentavam em sítios sistêmicos, como o baço, células TFH originadas das placas de Peyer. Essas células exibiam um perfil semelhante ao das células TH17, com maior expressão gênica e proteica de IL-17. Considerando que as células TFH clássicas têm mobilidade limitada, os autores investigaram possíveis mecanismos que permitiriam a migração células TFH17 das placas de Peyer para o baço. Eles identificaram que a expressão do receptor 1 de esfingosina-1-fosfato (S1PR1), fundamental para a migração de linfócitos de sítios linfáticos para a corrente sanguínea, estava aumentada nas células TFH17. Esse achado foi surpreendente, pois a expressão de S1PR1 normalmente é baixa em TFH clássicas.
Para investigar se as células TFH17 se originam de células TH17 ou de TFH clássicas, os autores utilizaram um modelo com mapeamento de destino, no qual todas as células que expressaram IL-17 em algum momento ficavam marcadas com a proteína fluorescente ZsGreen. Na presença de SFB, observaram aumento de células TFH ZsGreen+ nas placas de Peyer, indicando que essas TFH haviam expressado IL-17 anteriormente. Em um experimento de transferência celular, rastreando células TH17 e TFH clássicas, confirmaram que as TFH17 derivam das TH17, e não das TFH convencionais. Além disso, a colonização por SFB aumentou a expressão do fator de transcrição c-Maf em células TH17 nas PPs. A ausência de c-Maf reduziu a geração de TFH17 e melhorou parâmetros da AR, demonstrando que esse fator é crucial para a plasticidade que permite a conversão de TH17 em TFH17.
Sabendo que as células TFH17 presentes na AR se originam de células TH17 nas PPs, os autores investigaram sua relação com a ativação de linfócitos B e a produção aberrante de autoanticorpos. Eles observaram que as TFH17 apresentavam maior capacidade de interação com as células B, com expressão aumentada das moléculas coestimuladoras, tais como ICOS e OX40. Além disso, as TFH17 exibiram uma localização atípica nos centros germinativos, sendo encontradas na zona escura dos linfonodos, enquanto as TFH clássicas normalmente residem na zona clara. Essa localização foi associada a uma maior expressão do receptor CXCR4, responsável por guiar as células para a zona escura.
Em humanos, esses achados foram reforçados por evidências obtidas a partir da análise do sangue periférico de pacientes com AR, em comparação com controles saudáveis. Nesses indivíduos com AR, os autores identificaram uma maior frequência de células TFH17 circulantes expressando c-Maf e ICOS. A análise dos genes diferencialmente expressos nessa população revelou um perfil característico, associado à linhagem TH17, à origem intestinal e a uma maior capacidade de interação com células B.
Esses resultados revelam uma via patogênica previamente não caracterizada, na qual a microbiota intestinal induz a plasticidade de células TH17 em TFH17 com alto potencial de ativação de linfócitos B e geração de autoanticorpos, promovendo, assim, a autoimunidade sistêmica.
Fig. 1: No modelo de AR espontânea, a presença de SFB no intestino induz a plasticidade de células TH17, que passam a expressar c-Maf e adotam um perfil de células TFH17. Essas células expressam S1PR1, receptor que permite sua migração para sítios linfoides sistêmicos. Nos centros germinativos, as TFH17 localizam-se atipicamente na zona escura, guiadas pela expressão de CXCR4, e exibem maior capacidade de interação com linfócitos B, promovendo a produção de autoanticorpos e a exacerbando a AR. TFH17Der – células TFH17 derivadas de células TH17.
Referências
[1] Fan, T., Tai, C., Sleiman, K.C. et al. Aberrant T follicular helper cells generated by TH17 cell plasticity in the gut promote extraintestinal autoimmunity. Nat Immunol 26, 790–804 (2025). https://doi.org/10.1038/s41590-025-02125-7
[2] Ueno, H., Banchereau, J. & Vinuesa, C. Pathophysiology of T follicular helper cells in humans and mice. Nat Immunol 16, 142–152 (2015). https://doi.org/10.1038/ni.3054
[3] Hirota, K., Turner, JE., Villa, M. et al. Plasticity of TH17 cells in Peyer's patches is responsible for the induction of T cell-dependent IgA responses. Nat Immunol 14, 372-379 (2013). https://doi.org.10.1038/ni.2552



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)