Autoras: Rhanoica Guerra e Rafaela Souza
Editora: Daniela Carlos Sartori
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
Durante a respiração, os pulmões são constantemente expostos a partículas inaladas que podem danificar os tecidos e comprometer a homeostase pulmonar, contribuindo para o desenvolvimento de inflamações crônicas como a fibrose pulmonar. Macrófagos residentes no tecido pulmonar, os alveolares (AMs) e os intersticiais (IMs), desempenham papéis essenciais na manutenção da imunidade local, embora suas funções na fibrose pulmonar ainda não sejam completamente compreendidas. A citocina anti-inflamatória IL-10, produzida por várias células imunológicas, regula respostas pró-inflamatórias exacerbadas e atua na prevenção de respostas inflamatórias contra bactérias comensais, especialmente no intestino. No entanto, seu papel em outros tecidos periféricos permanece ainda pouco elucidado. A descoberta da presença de microbiota nos pulmões reforça a importância desse eixo de regulação, uma vez que a perda da sinalização de IL-10 pode comprometer a tolerância imunológica e favorecer o surgimento de doenças respiratórias. Nesse contexto, o artigo intitulado “IL-10 sensing by lung interstitial macrophages prevents bacterial dysbiosis-driven pulmonary inflammation and maintains immune homeostasis”, publicado no periódico Immunity, em Maio de 2025, Kim e cols. investigaram o impacto da sinalização imunossupressora da IL-10 na comunicação entre o sistema imunológico e o microbiota é crucial para a manutenção da homeostase pulmonar.1
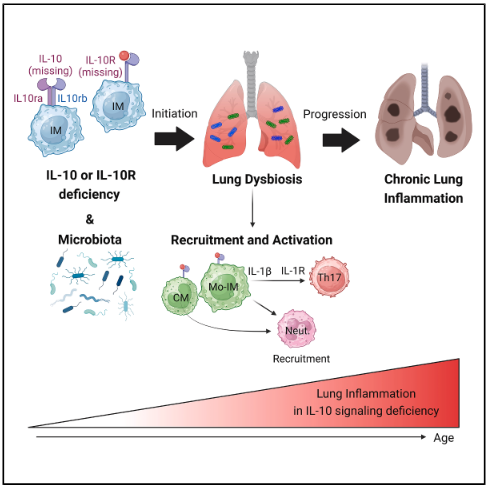
Com base no conhecimento consolidado sobre a atuação da IL-10 na homeostase intestinal, os autores buscaram investigar se essa via também exerce funções imunorregulatórias em outros tecidos periféricos. Para isso, os autores examinaram a histologia do fígado, rins, gordura epididimal e pulmões de camundongos selvagens (wild-type - WT) e deficientes para IL-10 (IL-10–/–), e observaram que inflamação grave estava presente na maioria dos lobos pulmonares dos animais IL-10–/– com 16 semanas de idade. Essa alteração estava associada com a idade, visto que animais IL-10–/– com 8 semanas de idade estavam livres da inflamação. Em seguida, utilizando citometria de fluxo, foi observada intensa migração de neutrófilos, monócitos clássicos (CMs) e de macrófagos intersticiais que expressavam MHC-II (MHC II + IMs) em camundongos IL-10–/– quando comparado aqueles WT. Adicionalmente, pela técnica de western blotting, foi visto o aumento de proteínas associadas a fibrose pulmonar tais como (descrever os fatores) nos mesmos animais, sugerindo que camundongos IL-10–/– apresentam espontaneamente inflamação pulmonar crônica, que progressivamente evoluem para fibrose pulmonar. Uma vez que, a sinalização IL-10 depende do seu receptor (IL-10R), objetivou-se determinar as células que expressam IL-10R no tecido pulmonar. Para isso, analisaram conjuntos de dados de RNA-seq do banco de dados ImmGen, assim, IL-10Ra e IL-10Rb foram expressos em macrófagos intersticiais e monócitos clássicos que expressam o receptor CX3CR1. Camundongos condicionais com a falta da expressão de IL-10Ra em células CX3CR1, demonstraram a mesma inflamação grave pulmonar, assim como sinais de colapso alveolar. Essa inflamação foi acompanhada pela presença de linfócitos Th17, os quais foram induzidos pela sinalização de IL-1β – IL-1R. Essa patogênese correlacionou com a prevalência de bactérias comensais pulmonares, principalmente D. acidovorans, R. erythropolis. Por fim, dado que a IL-10 é essencial para a manutenção da homeostase intestinal, e sua produção é influenciada pela microbiota intestinal, os autores buscaram investigar se a microbiota humana poderia induzir inflamação pulmonar no contexto da deficiência de IL-10. Para tanto, foi feito o transplante de microbiota fecal humana (TF) em animais IL -10–/– e WT livres de germes (germ free - GF). Foi notado que os camundongos IL-10–/– que receberam a o TF apresentaram no pulmão uma expressão diferencial de genes, quando comparado aqueles WT que também que receberam o TF, porém esses genes estavam ligados a resposta inata pró-inflamatória com migração de neutrófilos, CMs, IMs MHC II + e linfócitos Th17 e Th1 para o pulmão. Esses achados reforçam a importância da sinalização de IL-10 na resolução da resposta inflamatória induzida por disbiose, destacando seu papel essencial na manutenção da homeostase pulmonar.
Resumo gráfico – As interações entre a microbiota e o sistema imune são necessárias para manter a homeostase pulmonar do hospedeiro. A sinalização da via de IL-10 em macrófagos intersticiais (IMs) previne a inflamação pulmonar espontânea. Na deficiência de sinalização IL-10 – IL10R, a disbiose e a ativação dos IMs levam ao recrutamento de células imunes inflamatórias, a diferenciação de linfócitos Th17 através da sinalização IL-1β – IL-1R, o que acarreta em patologia pulmonar progressiva, que é intensificada com a idade podendo levar a inflamação crônica pulmonar.
Referências
- Kim SH, White Z, Gainullina A, et al. IL-10 sensing by lung interstitial macrophages prevents bacterial dysbiosis-driven pulmonary inflammation and maintains immune homeostasis. Immunity 2025; 58: 1306-1326.e7.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)