Alunos: Christian Alves e Keise Adrielle Pereira
Editora: Dra. Beatriz Rossetti Ferreira
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
O fígado é um dos poucos órgãos com grande capacidade de regeneração, essencial após cirurgias de câncer, traumas graves ou transplantes. Esse processo depende de uma complexa rede de sinais moleculares e celulares. Há muito tempo se sabe que neurotransmissores, como a acetilcolina (ACh), participam desse processo ao estimular células imunológicas e favorecer a proliferação de hepatócitos. Mas restava um mistério: se o fígado é principalmente inervado por fibras simpáticas que produzem norepinefrina, de onde vinha a ACh necessária para a regeneração hepática?
Uma pesquisa publicada recentemente na Immunity (Modares et al., 2025) trouxe uma resposta surpreendente: a fonte não são os neurônios, mas sim células B do sistema imunológico.
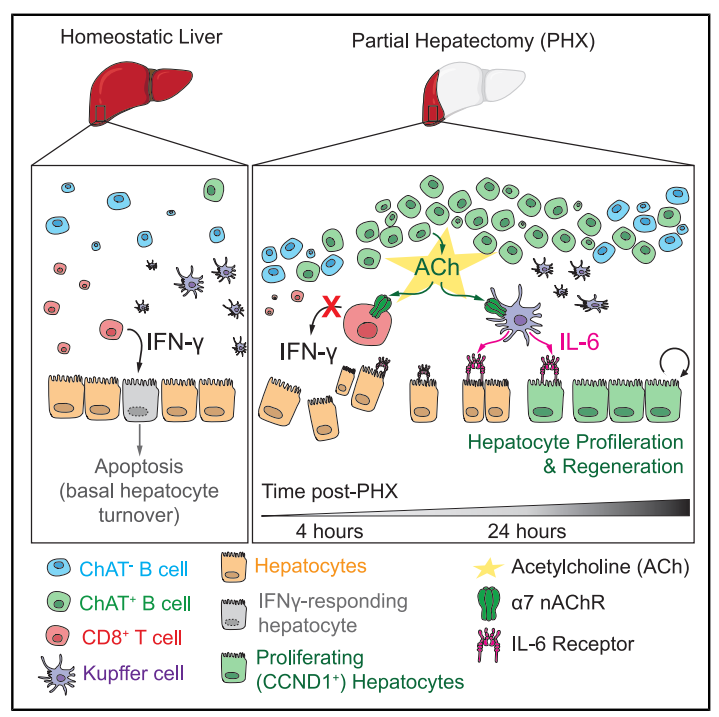
O estudo identificou que células B que expressam a enzima colina acetiltransferase (ChAT), responsável pela síntese de ACh, são essenciais para a regeneração hepática. Após hepatectomia parcial em camundongos, essas células B ChAT+ aparecem precocemente e garantem uma resposta rápida à lesão. Camundongos que não possuíam células B ChAT+ apresentaram uma taxa de mortalidade muito maior devido à falha na regeneração hepática, enquanto que a transferência de células B normais reverteu esse quadro.
Os autores também mostraram que a ACh derivada das células B atua em diferentes frentes: nas células de Kupffer e nas células T CD8+. Células de Kupffer são vitais para a regeneração hepática, pois produzem interleucina-6 (IL-6), uma citocina essencial para a proliferação de hepatócitos. Na ausência de células B ChAT+, as células de Kupffer produzem menos IL-6 e exibem um fenótipo imunossupressor, expressando genes como Il10, que suprime a produção de citocinas pró-inflamatórias. A depleção de células de Kupffer em camundongos aumentou a mortalidade após a hepatectomia parcial, um efeito que pôde ser revertido com a administração de IL-6 exógena. Isso indica que as células B ChAT+ devem estimular as células de Kupffer a produzir IL-6 suficiente para a proliferação adequada dos hepatócitos.
Já as células T CD8+ também desempenham um papel na recuperação, pois o estudo mostrou que ACh derivada das células B limita a produção excessiva de interferon-gama (IFN-g) pelas células T CD8+, que em altas concentrações prejudica a regeneração ao induzir apoptose dos hepatócitos. Em camundongos sem células B ChAT+, houve um aumento de quatro vezes no número de hepatócitos responsivos ao IFN-g. A depleção de células T CD8+ nessas condições restaurou a viabilidade dos camundongos.
Ainda em modelo murino, os autores mostraram que a ACh sinaliza para as células imunológicas através de receptores α7 nAChR. A ausência desse receptor, como observado em camundongos α7-KO, resultou em efeitos similares aos observados na deficiência de células B ChAT+, incluindo maior mortalidade e alterações na produção de citocinas. Em termos de mecanismo, a estimulação direta das células T CD8+ pela ACh reduziu a produção de IFN-g ao suprimir as vias de sinalização AKT e MAPK. Da mesma forma, a estimulação de macrófagos (células RAW 264.7) com ACh induziu a produção de IL-6 e a fosforilação de STAT3 de forma dependente do α7 nAChR.
Por fim, células B humanas também expressaram ChAT em resposta a estímulos como LPS e norepinefrina, enquanto que a ACh suprimiu a produção de IFN-g por células T CD8+ humanas. Esses achados sugerem que a regulação da regeneração hepática por células B colinérgicas pode ter uma ampla relevância clínica. Assim, compreender esses mecanismos abre caminho para estratégias terapêuticas inovadoras em casos de lesão hepática aguda ou doenças que afetam a regeneração do fígado.
Figura 1. Em condições homeostáticas, células T CD8⁺ produzem IFN-g, que induz apoptose de hepatócitos como parte do turnover basal. Após a hepatectomia parcial (PHX), células B produtoras que expressam colina acetiltransferase (células B ChAT+ ou ChAT⁺ B cells) secretam acetilcolina (ACh), a qual sinaliza por meio de receptores α7 nAChR em células de Kupffer, promovendo a produção de IL-6. Esse eixo ACh–IL-6 inibe a ação pró-apoptótica de IFN-g, estimulando a proliferação de hepatócitos (CCND1⁺) e favorecendo a regeneração hepática entre 4 e 24 h após a PHX.
Referência:
Modares NF, Hendrikse LD, Smith LK, et al. B cell-derived acetylcholine promotes liver regeneration by regulating Kupffer cell and hepatic CD8+ T cell function. Immunity, May 13, 2025. DOI: 10.1016/j.immuni.2025.04.002.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)