Autores: Francielle Ferreira e Jackeline Marino
Editor: Ademilson Panunto Castelo
Seminário apresentado junto ao Programa de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
O estudo intitulado “Plasma extracellular vesicle surface-located GAS6/PROS1 and CD39/CD73 attenuate inflammation”, publicado no periódico Cell Reports em agosto de 2025 por Fabiano e colaboradores1, traz novidades sobre como o organismo controla a inflamação utilizando vesículas extracelulares (EVs). A pesquisa demonstra que as EVs presentes no plasma de indivíduos saudáveis atuam como reguladores homeostáticos da imunidade inata e sugere que essas estruturas sejam equipadas com pelo menos dois mecanismos anti-inflamatórios distintos para atenuar processos inflamatórios. O trabalho também detalha o papel das EVs em dois tipos celulares-chave da imunidade inata: macrófagos e neutrófilos.
O papel de vesículas extracelulares (EVs) na imunidade tem ganhado cada vez mais destaque na última década, com uma literatura crescente que investiga seu potencial terapêutico em câncer, doenças neurodegenerativas e doenças autoimunes2. Estudos anteriores demonstraram que EVs extraídas do soro humano foram capazes de reduzir a produção de citocinas inflamatórias em macrófagos, favorecendo a polarização para o perfil M23,4. No entanto, o mecanismo pelo qual essa inibição da inflamação ocorre ainda não está completamente elucidado. Nesse contexto, Fabiano e colaboradores1 investigaram quais moléculas de superfície presentes em EVs circulantes no plasma humano são responsáveis pela modulação da inflamação e por meio de quais mecanismos celulares elas exercem esse efeito.
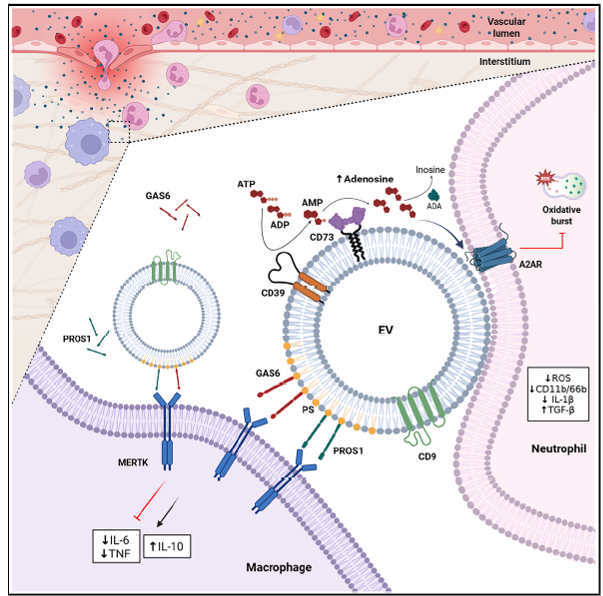
As EVs expõem fosfatidilserina (PS) em sua membrana, permitindo a associação desse lipídio com os ligantes GAS6 e PROS1. Essas moléculas atuam como pontes, ligando as EVs aos receptores da família TAM, especialmente ao receptor MERTK5. Esse aspecto é relevante, pois o MERTK, expresso em macrófagos, atua como um mediador central de processos pró-resolutivos da inflamação6. Sob essa perspectiva, o artigo demonstrou que a interação de GAS6/PROS1 na superfície das EVs com MERTK desencadeia uma via de sinalização anti-inflamatória nos macrófagos, elucidando o mecanismo pró-resolutivo das EVs nessas células. Essa via inibe a secreção de citocinas pró-inflamatórias, como IL-6 e TNF, ao mesmo tempo que estimula a produção de citocinas anti-inflamatórias, como IL-10.
Nos neutrófilos, a supressão da resposta inflamatória ocorre de forma independente dos receptores TAM e é mediada pelo sistema purinérgico. Os autores demonstraram que as EVs regulam a atividade desses leucócitos por meio das ectonucleotidases CD39 e CD73, localizadas em sua superfície. Essas enzimas degradam o ATP extracelular — uma molécula pró-inflamatória — em adenosina, que exerce efeito anti-inflamatório principalmente ao ativar o receptor A2A (A2AR). A ativação do A2AR aumenta os níveis intracelulares de AMPc, reduzindo a produção de espécies reativas de oxigênio, atenuando o estresse oxidativo nos neutrófilos e promovendo a secreção de citocinas anti-inflamatórias, como TGF-β.
Por fim, o estudo mostra que os neutrófilos servem de “ponte” para as EVs interagirem com os macrófagos. Isso porque as EVs aderem à superfície dos neutrófilos, permanecendo estáveis. Quando esses neutrófilos entram em contato com os macrófagos, os ligantes GAS6 e PROS1 conseguem interagir com o receptor MERTK e atenuar a resposta inflamatória.
Em conclusão, o estudo sugere que as EVs plasmáticas atuam como um mecanismo homeostático para prevenir inflamações desnecessárias. A incubação de neutrófilos com EVs favorece sua interação com macrófagos, promovendo a formação de conjugados célula-célula e modulando a resposta dos macrófagos, com redução da produção de IL-6 e aumento de IL-10 (Figura 1). Esses achados indicam que as EVs não apenas regulam a resposta inflamatória, mas também contribuem para a resolução da inflamação ao facilitar interações celulares pró-resolutivas.
Figura 1. Resumo dos achados do estudo1: As EVs podem carregar em sua superfície quatro moléculas. GAS6 e PROS1 interagem com o receptor MERTK em macrófagos, promovendo uma resposta anti-inflamatória. Já CD39 e CD73 convertem ATP extracelular em adenosina, que se liga ao receptor A2AR de neutrófilos para reduzir a inflamação. Além disso, as EVs podem aderir à superfície dos neutrófilos, facilitando sua interação com macrófagos.
REFERÊNCIAS
- Fabiano MP, Adamczyk AM, Gololobova OA, et al. Plasma extracellular vesicle surface-located GAS6/PROS1 and CD39/CD73 attenuate inflammation. Cell Rep 2025; 44: 116096.
- Kumar MA, Baba SK, Sadida HQ, et al. Extracellular vesicles as tools and targets in therapy for diseases. Signal Transduct Target Ther 2024; 9: 27.
- Adamczyk AM, Leicaj ML, Fabiano MP, et al. Extracellular vesicles from human plasma dampen inflammation and promote tissue repair functions in macrophages. J Extracell vesicles 2023; 12: e12331.
- Li K, Yan G, Huang H, et al. Anti-inflammatory and immunomodulatory effects of the extracellular vesicles derived from human umbilical cord mesenchymal stem cells on osteoarthritis via M2 macrophages. J Nanobiotechnology 2022; 20: 38.
- Burstyn-Cohen T, Fresia R. TAM receptors in phagocytosis: Beyond the mere internalization of particles. Immunol Rev 2023; 319: 7–26.
- Kim S-Y, Lim E-J, Yoon Y-S, et al. Liver X receptor and STAT1 cooperate downstream of Gas6/Mer to induce anti-inflammatory arginase 2 expression in macrophages. Sci Rep 2016; 6: 29673.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)