Autores: André Correa e Maísa Leandro
Editor: Ademilson Panunto Castelo
Seminário apresentado na disciplina Tópicos Avançados de Imunologia do Programa de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
Em um estudo intitulado “TNF and type I interferon crosstalk controls the fate and function of plasmacytoid dendritic cells”, publicado no periódico Nature Immunology em agosto de 2025, Rebeca Arroyo e colaboradores1 revelaram como o destino das células dendríticas plasmocitoides é afetado pelo fator de necrose tumoral e pelo interferon do tipo I.
As células dendríticas (DCs) constituem um grupo altamente especializado de células do sistema imunológico. As DCs plasmocitoides (pDCs) são conhecidas como as principais produtoras de interferon do tipo I (IFN-I), uma citocina crucial para a resposta antiviral. Por outro lado, as DCs convencionais (cDCs) são especializadas na captura de antígenos e na apresentação destes às células T, iniciando a resposta imunológica adaptativa.
Durante muito tempo, discutiu-se se as pDCs, após a ativação, poderiam perder sua identidade de “produtoras de IFN-I” e se transformar em cDCs apresentadoras de antígenos. Esse processo de mudança de destino (fate-switching) era controverso devido às limitações técnicas para rastrear células individuais ao longo do tempo.
Para investigar mais profundamente esse fenômeno, Arroyo e colaboradores empregaram tecnologias avançadas que permitiram avaliar o potencial das pDCs de perder sua identidade e adquirir características funcionais de cDCs, identificar os mecanismos moleculares envolvidos nessa transição e verificar se ela também ocorre in vivo em humanos.
Os pesquisadores purificaram rigorosamente pDCs humanas e as ativaram in vitro. Usando a técnica snMultiome-seq (que mapeia genes e cromatina em células únicas), eles observaram que as pDCs ativadas por ligante de CD40 (CD40L) na presença de IL-3 seguiam uma trajetória de diferenciação. Elas se dividiram em três grupos: pDCs, que mantiveram sua identidade, itDCs, células proliferativas com um perfil intermediário, e icDC2s, uma população final (icDC2) que perdeu a expressão de genes mestres de pDC (como TCF4) e ativou o programa genético completo de uma cDC2 (como SIRPA e IRF4).
Ao analisar o perfil das células icDC2, os autores concluíram que essa nova população era estável e que sua diferenciação ocorria de forma unidirecional, sem retorno ao estado de pDCs. Funcionalmente, as icDC2s perderam completamente a capacidade de produzir IFN-I, mas ganharam todas as funções de uma cDC:
- apresentaram morfologia dendrítica em vez da forma arredondada característica das pDCs,
- tornaram-se altamente eficientes na captura e processamento de antígenos (como bactérias) e, o mais importante,
- atuaram como potentes ativadoras de células T, uma função ausente nas pDCs originais.
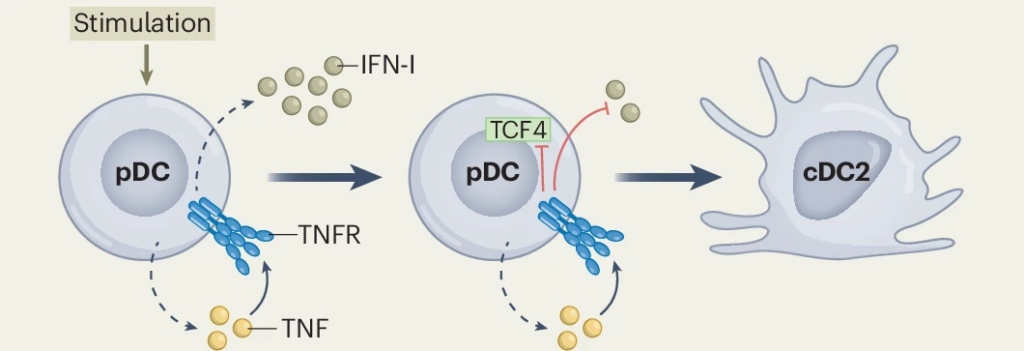
O mecanismo por trás dessa mudança revelou-se um “interruptor” controlado por duas citocinas opostas: o TNF, que atua como o “acelerador”, promovendo a conversão fenotípica ao desligar o gene mestre TCF4; e o IFN-I que funciona como um “freio”, impedindo essa transição (Figura 1). Os autores descobriram que o IFN-I bloqueia a mudança ao reduzir a expressão dos receptores de TNF em pDC, tornando-a “cega” ao sinal de conversão.
Por fim, os pesquisadores mostraram que esse processo também ocorre em diferentes contextos in vivo: ao analisar amostras de pele inflamada, identificaram a presença das mesmas icDC2s. Além disso, observaram que pDCs de indivíduos idosos (naturalmente expostos a níveis cronicamente elevados de TNF) apresentavam menor expressão de TCF4 e se convertiam em icDC2s com muito mais facilidade do que as pDCs de indivíduos jovens.
Em conclusão, o estudo demonstra que as pDCs constituem uma população celular plástica, com potencial para se diferenciar em cDC2s funcionalmente ativas. Esse destino é ditado por um balanço entre o TNF (que promove a mudança) e o IFN-I (que a bloqueia).
Figura 1. Uma pDC estimulada (por exemplo, por CD40L e IL-3) começa a secretar duas citocinas opostas: TNF e IFN-I. O TNF atua na própria célula, ligando-se ao seu receptor (TNFR). Essa sinalização inibe ao expressão do TCF4, o fator de transcrição mestre que mantém o fenótipo e a funcionalidade das pDCs. Com o TCF4 suprimido, a célula se reprograma, perde sua identidade original e se diferencia em uma cDC2 funcional. O IFN-I atua como um “freio” a essa conversão, bloqueando a sinalização do TNFR e impedindo que o TCF4 seja inibido, preservando a identidade da célula e mantendo-a como uma pDC.
Fonte: Segura, 2025.2
Referencias:
- Arroyo Hornero, R., Maqueda-Alfaro, R.A., Solís-Barbosa, M.A. et al. TNF and type I interferon crosstalk controls the fate and function of plasmacytoid dendritic cells. Nat Immunol 26, 1540–1552 (2025). https://doi.org/10.1038/s41590-025-02234-3
- Segura, E. TNF gives plasmacytoid dendritic cells a new life. Nat Immunol 26, 1432–1433 (2025). https://doi.org/10.1038/s41590-025-02254-z



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)