Ontem, 20 de janeiro, a Diretoria Colegiada da Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, por unanimidade, o uso pediátrico da vacina Coronavac.
A autorização de uso emergencial para a inclusão de nova faixa etária em bula foi concedida especificamente para o público entre 6 e 17 anos, crianças e adolescentes não imunocomprometidos, baseada em estudos realizados em diversos países, como China e Chile, e apresentados pelo Instituto Butantan no processo.
Para esse público a dose aprovada do imunizante, produzido a partir de vírus inativado, é a mesma usada para adultos (600 SU em 0,5 ml), com um intervalo de 28 dias entre a primeira e a segunda aplicação.
No decorrer do processo foram avaliados estudos clínicos de fase I e II, dados preliminares dos estudos de eficácia, segurança e imunogenicidade (fase III) realizados com 14 mil crianças em cinco diferentes países, e de estudos de efetividade (fase IV) realizados com milhões de crianças no Chile. As evidências científicas disponíveis até o momento sugerem que há benefícios e segurança para a utilização da vacina na população pediátrica.
Saiba mais no site da Anvisa: neste link.

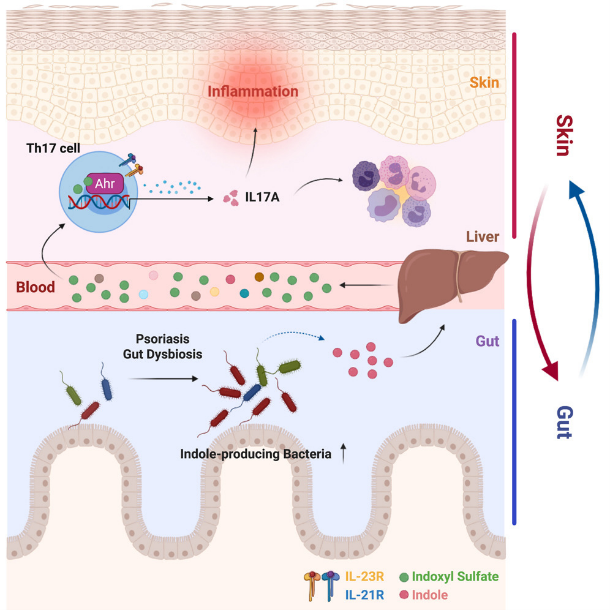
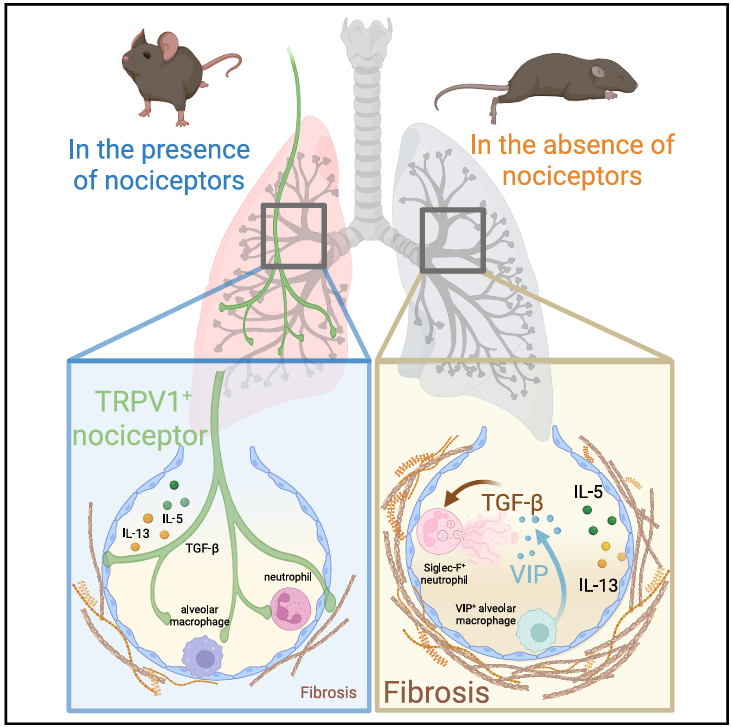
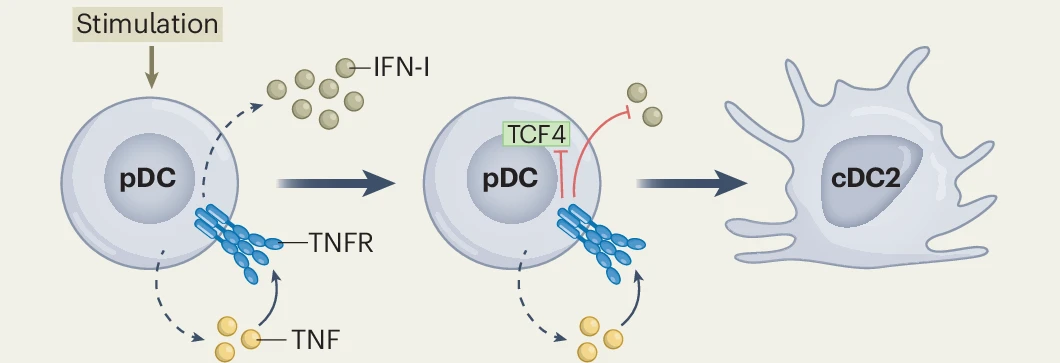
- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










