Por: Mariana Soares Pena Ribeiro e Murilo Duarte-Silva (doutorandos IBA/FMRP-USP)
Editora: Luciana Benevides
Os receptores Toll-like (TLRs) são sensores que reconhecem padrões moleculares específicos, como ácidos nucléicos de vírus e protozoários. Uma vez ativados, os TLRs podem recrutar MyD88 e induzir a produção de citocinas pró-inflamatórias (IL-6 IL-1-beta, TNF-alfa), as quais cumprem diversas funções, dentre elas o desenvolvimento de células mielóides e a diferenciação de macrófagos (1). Os TLR7 e TLR9 endossomais são exemplo dessa via, por recrutar MyD88 e ativar fatores de transcrição como o IRF5. Uma vez ativado, IRF5 transloca para o núcleo e ativa a transcrição gênica de genes pró-inflamatórios (2). Em consonância, animais que superexpressam TLR7 induzem a diferenciação de macrófagos, além de apresentarem anemia por redução do número de eritrócitos e hematócrito (3).
No baço há uma população de macrófagos, chamados da polpa vermelha (RPMs), que são descritos por exercer a função fisiológica de fagocitar eritrócitos (4). Ademais, a fagocitose de células vermelhas por macrófagos é exacerbada na síndrome de ativação macrofágica (MAS). A disfunções primárias genéticas, doenças inflamatórias ou infecções podem favorecer o desenvolvimento da MAS, que é uma condição patológica secundária. Os sintomas característicos da MAS é o aumento excessivo da produção de citocinas, citopenias, febre alta, esplenomegalia, disfunção hepática e anemia de cunho inflamatório (5,6).
Recentemente, Akilesh et al. (7), mostraram que monócitos Ly6Chi ativados cronicamente com TLR7 e TLR9 diferenciam-se em macrófagos hemofagocítos inflamatórios (iHPCs), células antes não descritas. A diferenciação desse fenótipo de macrófago especializado pode ser feita a partir de infecções virais ou por protozoários, como Plasmodium, que geram PAMP’s ligantes de TLR7 e TLR9. Os iHPCs tem um programa de diferenciação específico, que depende de IRF5, mas não do gene Spi-C, que regula a diferenciação dos RPMs. Além disso, os autores mostraram que iHPCs tem uma maior capacidade de fagocitose de eritrócitos que os RPMs. Essas células são as principais contribuintes para o desenvolvimento de citopenias inflamatórias, como a anemia vista na MAS (Figura 1). Esses dados abrem um novo prisma para a exploração de novos tratamentos de anemias inflamatórias, tendo em consideração a diferenciação de iHPCs.
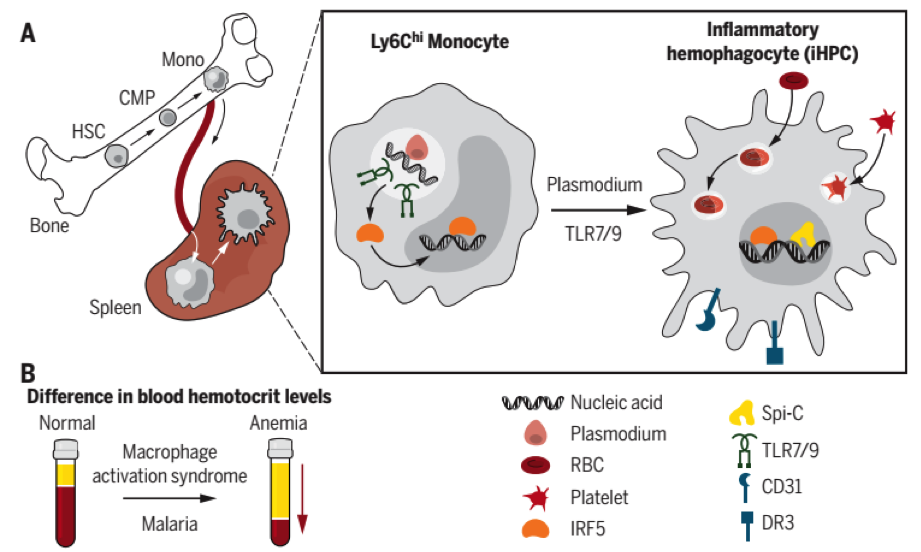
Figura 1. Monócitos Ly6Chi de origem hematopoiética migram para o baço, ao serem infectados por Plasmodium tem a ativação crônica dos TLR7 e TLR9. Essa ativação recruta a participação de IRF5 que migra para o núcleo ativando a transcrição de genes específicos, como Spi-C. Esse perfil gênico trancricional promove a diferenciação dos monócitos em hemofagócitos inflamatórios (iHPC), que são caracterizados pela expressão de CD31 e DR3. Diferenciadas, essas células contribuem para o desenvolvimento de anemias inflamatórias por fagocitarem hemácias e plaquetas na síndrome de ativação macrofágica ou na malária (7).
Referências
- Honda, K. & Taniguchi, T. IRFs: master regulators of signalling by Toll-like receptors and cytosolic pattern-recognition receptors. Nat. Rev. Immunol. 6, 644–658 (2006).
- Deryabin, D. G. & Polyakov, E. G. Effect of human serum on bioluminescence of natural and recombinant luminescent bacteria. Bull. Exp. Biol. Med. 138, 276–279 (2004).
- Deane, J. A. et al. Control of toll-like receptor 7 expression is essential to restrict autoimmunity and dendritic cell proliferation. Immunity 27, 801–810 (2007).
- Kohyama, M. et al. Role for Spi-C in the development of red pulp macrophages and splenic iron homeostasis. Nature 457, 318–321 (2009).
- Yanagimachi, M. et al. Association of IRF5 polymorphisms with susceptibility to macrophage activation syndrome in patients with juvenile idiopathic arthritis. J. Rheumatol. 38, 769–774 (2011).
- Bracaglia, C., Prencipe, G. & De Benedetti, F. Macrophage Activation Syndrome: different mechanisms leading to a one clinical syndrome. Pediatr Rheumatol Online J 15, 5 (2017).
- Akilesh, H. M. et al. Chronic TLR7 and TLR9 signaling drives anemia via differentiation of specialized hemophagocytes. Science 363, (2019).

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










