Autoras: Sandra M. Muxel e Emanuella Sarmento - (ICB-USP)
Foi anunciado no dia 07 de outubro de 2024, o Prêmio Nobel de Medicina ou Fisiologia 2024 para os pesquisadores americanos Victor Ambros e Gary Ruvkun pela descoberta dos microRNAs e descrição de sua função na regulação da expressão gênica.
Victor Ambros e Gary Ruvkun iniciaram seus trabalhos com o modelo da larva Caenorhabditis elegans durante o pós-doutorado no Laboratório do Prof. Robert Horvitz (Nobel Prize in 2002) na década de 80. Eles caracterizaram o envolvimento dos genes lin-4 e lin-14 no desenvolvimento larval. Lin-4 foi clonado e caracterizado como um RNA pequeno em forma de grampo (hairpin) por Rosalind Lee e Rhonda Feibaun, em 1993. A seguir, Ruvkun e Ambros identificaram sequências complementares a lin-4 e lin-14 na região 3' untranslated (3'UTR) do mRNA da proteína LIN-14 e regula negativamente os níveis da proteína LIN-14, ou seja, regulação pós-transcricional do gene LIN-14, afetando o desenvolvimento de C. elegans1,2.
Em 2000, o grupo de Ruvkun descreveu o miRNA let-7e como regulador do gene LIN-41. Ruvkun identificou que let-7 é conservado ao longo da evolução dos organismos, desde ouriços-do-mar, artrópodes, equinodermas, peixes, répteis, primatas, roedores e mamíferos como o homem1,2. Let-7e regula vários genes envolvidos na via de sinalização de TLR-NF-kB, impactando na produção de citocinas pró-inflamatórias e Óxido Nítrico, regulando mecanismos microbicidas em macrófagos3.
É empolgante ver como essas moléculas tão pequenas têm um grande potencial para regular a diferenciação de células, determinar características de um tecido ou o desenvolvimento de um organismo multicelular, como C. elegans, camundongos, seres humanos e plantas. Vale ressaltar que, um microRNA pode interagir com muitos mRNAs-alvo e uma região 3'UT do mRNA pode ter muitas sequências de interação com o miRNAs. Isso fornece uma rede complexa de interação e possibilidade de regulação miRNA-mRNA.
Ao longo dos 30 anos da descoberta dos miRNAs já se esclareceu sua função na regulação de vários processos fisiológicos, inclusive na hematopoiese, ativação, diferenciação e regulação de funções das células do sistema imune, seja em homeostase ou situações de dano, infecções (vírus, bactérias, fungos e parasitas) e câncer. Os miRNAs também auxiliam no desenvolvimento da resposta e geração de memória imunológica na vacinação. Também estão envolvidos na regulação da resposta imune na interface materno fetal em placenta de gestantes com HIV ou no neurodesenvolvimento de fetos em gestantes com Zika vírus, como vemos nos estudos desenvolvidos por imunologistas no Brasil.
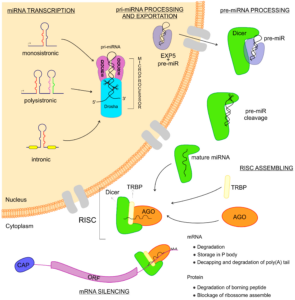
O que sabemos hoje: Os microRNAs são pequenos RNAs com 22 a 25 nucleotídeos e que não codificam proteínas, chamados de não codificadores (do inglês, noncoding RNAs, Figura 1). A sequência de 7-8 nucleotídeos do miRNA que define interação por complementariedade com a sequência 3'UTR do mRNA-alvo, chamada de sequência seed. A interação miRNA-mRNAs pode regular negativamente os níveis do mRNA e da proteína por ele codificada4. Vale ressaltar que a processamento e função dos miRNAs é feita juntamente pelo complexo RISC, com a associação das proteínas DICER e Argonautas. A presença da proteína DICER é essencial para o desenvolvimento de camundongos, como visto nos modelos de nocautes do gene DICER5.
A função dos miRNAs pode ser investigada através do uso de inibidores ou antagomiRs ou shRNAs, reduzindo a disponibilidade do miRNA na células ou pela superexpressão dos miRNAs, através de mímicos. Hoje temos modelos de nocauteamento total condicional de miRNAs, DICER e Argonautas.
Existem estudos clínicos utilizando miRNAs como estratégia terapêutica, como o uso do anti-miR-155 Cobomarsen (MRG-106), estudo clínico fase II aprovado para tratamento de câncer hematológico. Além disso, o potencial terapêutico do miR-155 (MRG-107) está sendo investigado como tratamento para Esclerose Lateral Amiotrófica com estágio pré-clínico concluído6. O miR-155 é bem caracterizado por sua função na regulação positiva da resposta inflamatória, por regular os fatores de regulação negativa SHIP1 e SOCS-17. Outro exemplo interessante é anti-miR-122 (Miravirsen/SPC3649) que está sendo utilizado em estudo clínico fase II) para o tratamento de hepatite C crônica6.
Ainda estamos trabalhando para responder a grande pergunta sobre como os miRNAs, que não codificam proteínas, são tão importantes na função de regulação da homeostase e resposta imune?
O advento do sequenciamento de nova geração e as tecnologias de clonagem gênica e silenciamento gênico trazem novas perspectivas para estudar a função dos miRNA, seu uso como biomarcadores de doenças e prognóstico. A versatilidade dos miRNAs tornam essas moléculas uma grande ferramenta para o desenvolvimento de novas terapias.
Figura 1. Biogênese dos microRNAs (miRNAs). Os miRNAs são pequenos RNAs não codificantes transcritos a partir de sequências de DNA, que podem ser monocistrônicos ou policistrônicos, presentes em éxons, íntrons ou em um gene hospedeiro único. Logo após a transcrição, essa nova sequência de RNA é chamada de pri-miRNA (microRNA primário), que se dobra em uma conformação de grampo e é acoplada ao microprocessador: uma combinação das RNAses DGCR8 e Drosha, que cortam o pri-miRNA, transformando-o em um pré-miRNA. Em seguida, o pré-miRNA é acoplado à Exportina 5 e exportado para o citoplasma, onde este complexo é encontrado pela Dicer, que corta o pré-miRNA, liberando dois braços de miRNA maduro. O miRNA maduro acoplado à Dicer pode, então, se unir às proteínas Argonauta e TRBP, formando assim o Complexo de Silenciamento Induzido por RNA–RISC. Quando o RISC está completo, ele pode localizar os RNAs mensageiros que são alvos do miRNA acoplado. Uma vez encontrado, a mensagem é silenciada e a expressão gênica regulada.
Referências:
- AMBROS, Victor. The evolution of our thinking about microRNAs. Nature medicine, v. 14, n. 10, p. 1036-1040, 2008.
- LEE, Rosalind C.; FEINBAUM, Rhonda L.; AMBROS, Victor. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. cell, v. 75, n. 5, p. 843-854, 1993.
- MUXEL, Sandra Marcia et al. Toll-like receptor and miRNA-let-7e expression alter the inflammatory response in leishmania amazonensis-infected macrophages. Frontiers in Immunology, v. 9, p. 2792, 2018.
- ACUÑA, Stephanie Maia; FLOETER-WINTER, Lucile Maria; MUXEL, Sandra Marcia. Review MicroRNAs: Biological Regulators in Pathogen–Host Interactions. Cells (2073-4409), v. 9, n. 1, 2020.
- SOUKUP, Garrett A. et al. Residual microRNA expression dictates the extent of inner ear development in conditional Dicer knockout mice. Developmental biology, v. 328, n. 2, p. 328-341, 2009.
- SEYHAN, Attila A. Trials and tribulations of MicroRNA therapeutics. International Journal of Molecular Sciences, v. 25, n. 3, p. 1469, 2024.
- O'CONNELL, Ryan M. et al. MicroRNA-155 is induced during the macrophage inflammatory response. Proceedings of the National Academy of Sciences, v. 104, n. 5, p. 1604-1609, 2007.
- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)