Autoras: Amanda Becerra e Caroline V. de Oliveira
Editora: Beatriz Rossetti Ferreira
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada USP/RP
Referência: Kotov DI, Lee OV, Fattinger SA, Langner CA, Guillen JV, Peters JM, et al. (2023). Early cellular mechanisms of type I interferon-driven susceptibility to tuberculosis. Cell, 186(25): 5536-5553.e22. https://doi.org/10.1016/j.cell.2023.11.002
A tuberculose, uma doença altamente contagiosa causada pelo Mycobacterium tuberculosis, continua a representar uma das maiores ameaças à saúde global, principalmente em regiões com recursos limitados1. Apesar dos avanços na compreensão da sua patogênese e no desenvolvimento de tratamentos, persistem lacunas significativas em nosso entendimento dos mecanismos celulares que regem a suscetibilidade e a progressão dessa infecção2,3,4,5.
Os interferons do tipo I (IFN-I), uma classe de citocinas com funções cruciais na resposta imune antiviral, são mediadores controversos na fisiopatologia da tuberculose6. Embora estudos anteriores tenham sugerido um papel protetor dos IFN-I, evidências recentes indicam o contrário, que poderiam contribuir para com o agravamento da doença7,8,9,10. Assim, no estudo em questão, os pesquisadores buscaram aprofundar a compreensão da interação entre os IFN-I e a tuberculose, visando elucidar como atuaria na resposta imune do hospedeiro e os mecanismos celulares subjacentes à suscetibilidade à tuberculose. Essa investigação é importante para o desenvolvimento de estratégias mais eficazes no tratamento da tuberculose.
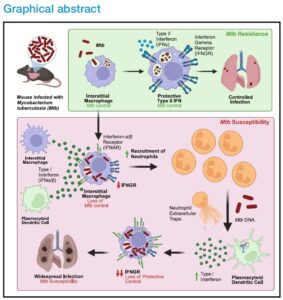
Inicialmente, buscando identificar o perfil celular envolvido durante o início da infecção por Mtb em animais susceptíveis, knockouts para Sp140 – o gene dentro da região gênica Sst1 que controla a susceptibilidade ao Mtb11 - ou não, os pesquisadores realizaram citometria do tecido pulmonar de animais após 25 dias da inoculação com a bactéria e observaram que as células mais infectadas pertencem à linhagem mieloide, além disso ocorrer de forma dependente de IFNs do tipo I, uma vez que animais Sp140-/-Ifnar1-/- se tornam menos susceptíveis; corroborando com trabalho anterior do grupo.
Para entender melhor sobre a susceptibilidade à infecção gerada pelos IFNs do tipo I, foi necessário identificar quais os tipos celulares estariam produzindo essas citocinas. Análises de sequenciamento de RNA de célula única (scRNA-seq) mostraram que nos dias 19 e 25 pós infecção não se observou um número expressivo de células expressando Ifnb1 (gene que codifica para IFN-β). Para contornar isso, os pesquisadores geraram animais I-Tomcat Ai6+, cujas células expressam proteína fluorescente verde se em algum momento da sua vida expressaram Ifnb1. Curiosamente, com o uso desses animais, foi possível identificar que as principais fontes de IFNs do tipo I mediante à infecção com Mtb não são as células infectadas, mas sim células dendríticas plasmocitóides (pDCs) e macrófagos intersticiais (IMs) vizinhos. Confirmando esses resultados, a depleção de pDCs reduziu as unidades formadoras de colônias (CFUs) de bactérias a níveis observados em animais Sp140-/-Ifnar1-/- (resistentes a Mtb). Ainda, essas pDCs apresentaram níveis aumentados de expressão de genes induzidos por interferon (ISGs) e foram identificadas ao redor de granulomas em cortes histológicos de linfonodos e de pulmões de pacientes infectados com Mtb.
Ao analisar as células presentes no sítio da infecção por Mtb foi observada a presença de um número significativo de neutrófilos em animais Sp140-/-e que a presença dessas células induz a produção de armadilhas extracelulares de neutrófilos (NETs), como demonstrado pela imunofluorescência de histona H3 citrulinada. Esse achado sugere que essas NETs, produzidas pelos neutrófilos alí presentes em maior número, estariam ativando as pDCs via TLR7 e 9, já que as pDCs não podem ser diretamente infectadas e tipicamente produzem IFNs do tipo I mediante reconhecimento de ácidos nucleicos extracelulares.
Até o momento, o trabalho identificou quais as principais células produtoras de IFNs do tipo I; mas quais seriam as células que respondem a essas citocinas? Para responder essa importante questão foram realizados experimentos de scRNA-seq para ver quais os tipos celulares que apresentaram assinaturas gênicas de resposta ao IFN-β (deletério no contexto de infecção por Mtb) e ao IFN-γ (benéfico no mesmo contexto), ou ambos em animais WT e Sp140-/-. Apesar do scRNA-seq indicar uma assinatura de resposta a IFNs do tipo I mais presente em neutrófilos e IMs, experimentos usando animais knockouts condicionais para Ifnar1 em macrófagos (CD64-Cre Ifnar1-Fl/Fl) e neutrófilos (Mrp8-Cre Ifnar1-Fl/Fl) mostram que essas citocinas agem em IMs de forma que previne a sinalização de IFN-γ nestas células, reduzindo sua habilidade de conter o crescimento de Mtb.
Assim, o presente trabalho se mostra como um dos pioneiros na investigação sobre como a resposta de IFNs do tipo I, apesar de ser pró-inflamatória, pode piorar o quadro de tuberculose; podendo contribuir com o desenvolvimento de novas formas de tratamento da doença.
REFERÊNCIAS
- WHO (2021). Global tuberculosis report 2021. https://www.who.int/publications-detail-redirect/9789240037021
- Cooper, A.M., Dalton, D.K., Stewart, T.A., Griffin, J.P., Russell, D.G., and Orme, I.M. (1993). Disseminated tuberculosis in interferon gamma gene disrupted mice. J. Exp. Med. 178, 2243–2247. https://doi.org/10.1084/ jem.178.6.2243.
- Flynn, J.L., Goldstein, M.M., Chan, J., Triebold, K.J., Pfeffer, K., Lowenstein, C.J., Schreiber, R., Mak, T.W., and Bloom, B.R. (1995). Tumor necrosis factor-alpha is required in the protective immune response against Mycobacterium tuberculosis in mice. Immunity 2, 561–572. https://doi.org/10.1016/1074-7613(95)90001-2
- Flynn, J.L., Chan, J., Triebold, K.J., Dalton, D.K., Stewart, T.A., and Bloom, B.R. (1993). An essential role for interferon gamma in resistance to Mycobacterium tuberculosis infection. J. Exp. Med. 178, 2249–2254. https://doi.org/10.1084/jem.178.6.2249
- Berry, M.P.R., Graham, C.M., McNab, F.W., Xu, Z., Bloch, S.A.A., Oni, T., Wilkinson, K.A., Banchereau, R., Skinner, J., Wilkinson, R.J., et al. (2010). An interferon-inducible neutrophil-driven blood transcriptional signature in human tuberculosis. Nature 466, 973–977. https://doi.org/10.1038/ nature09247
- Moreira-Teixeira, L., Mayer-Barber, K., Sher, A., and O’Garra, A. (2018). Type I interferons in tuberculosis: foe and occasionally friend. J. Exp. Med. 215, 1273–1285. https://doi.org/10.1084/jem.20180325
- Scriba, T.J., Penn-Nicholson, A., Shankar, S., Hraha, T., Thompson, E.G., Sterling, D., Nemes, E., Darboe, F., Suliman, S., Amon, L.M., et al. (2017). Sequential inflammatory processes define human progression from M. tuberculosis infection to tuberculosis disease. PLoS Pathog. 13, e1006687. https://doi.org/10.1371/journal.ppat.1006687
- Martinez, L., Nicol, M.P., Wedderburn, C.J., Stadler, A., Botha, M., Workman, L., le Roux, D.M., and Zar, H.J. (2021). Cytomegalovirus acquisition in infancy and the risk of tuberculosis disease in childhood:a longitudinal birth cohort study in Cape Town, South Africa. Lancet Glob. Health 9, e1740–e1749. https://doi.org/10.1016/S2214-109X(21) 00407-1
- Muller, J., Tanner, R., Matsumiya, M., Snowden, M.A., Landry, B., Satti, I., Harris, S.A., O’Shea, M.K., Stockdale, L., Marsay, L., et al. (2019). Cytomegalovirus infection is a risk factor for tuberculosis disease in infants. JCI Insight 4, 130090. https://doi.org/10.1172/jci.insight.130090
- Walaza, S., Tempia, S., Dawood, H., Variava, E., Moyes, J., Cohen, A.L., Wolter, N., Groome, M., von Mollendorf, C., Kahn, K., et al. (2015). Influenza virus infection is associated with increased risk of death amongst patients hospitalized with confirmed pulmonary tuberculosis in South Africa, 2010–2011. BMC Infect. Dis. 15, 26. https://doi.org/10.1186/s12879-015-0746-x
- Ji, D.X., Witt, K.C., Kotov, D.I., Margolis, S.R., Louie, A., Cheve´ e, V., Chen, K.J., Gaidt, M.M., Dhaliwal, H.S., Lee, A.Y., et al. (2021). Role of the transcriptional regulator SP140 in resistance to bacterial infections via repression of type I interferons. Elife. 21;10:e67290. https://doi/10.7554/eLife.67290
- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)