Autores: Christian Alves e Samuel Oliveira
Editora: Beatriz Rossetti Ferreira
Seminário apresentado na disciplina Tópicos Avançados de Imunologia do Programa de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
Em um estudo intitulado “Antitumor progenitor exhausted CD8+ T cells are sustained by TCR engagement”, publicado no periódico Nature Immunology em maio de 2024, Xin Lan e cols. revelaram como a força de ativação do TCR impacta na formação de células Tpex, na sua capacidade proliferativa e na sua longevidade em tumores e nos linfonodos drenantes, parâmetros importantes para a avaliação da responsividade a terapias de check point imunológico.
As células T CD8+ desempenham um papel essencial na eliminação de células tumorais, atuando como uma linha de defesa através da vigilância imunológica. Quando essas células reconhecem os neoantígenos tumorais, elas montam uma resposta imunológica robusta, essencial para o controle do câncer. No entanto, se essa resposta for insuficiente e o tumor persistir, ocorre um fenômeno conhecido como exaustão celular, que resulta de uma estimulação prolongada do receptor de células T (TCR). A exaustão celular é caracterizada pela perda da capacidade proliferativa das células T, aumento da expressão de receptores inibitórios e respostas efetoras desreguladas.
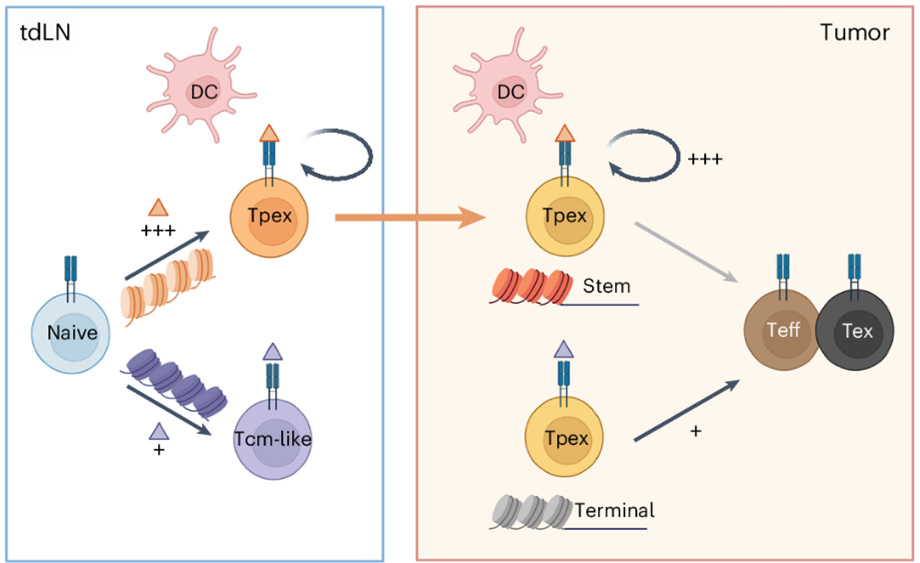
Dentro desse processo, surge um subgrupo de células T CD8+, conhecido como células T progenitoras exauridas (Tpex). Essas células se destacam por apresentarem altos níveis de expressão de proteínas como o Fator de Célula T 1 (TCF1), a Proteína da Caixa de Alta Mobilidade associada à seleção de timócitos (TOX) e o Ly108, também conhecido como SLAMF6 (Membro 6 da Família de Moléculas de Ativação Linfocitária por Sinalização). Ao contrário das células terminalmente exauridas (Tex), as Tpex mantêm características de células progenitoras, como a capacidade de autorrenovação e diferenciação em células T efetoras, o que as torna promissoras para o desenvolvimento de novas imunoterapias contra o câncer.
Entre as estratégias imunoterapêuticas, o bloqueio do ponto de verificação imunológicos tem mostrado potencial para reverter temporariamente a exaustão celular. Estudos indicam que a presença de Tpex está associada a respostas mais eficazes a essa terapia. Isso se deve à alta proliferação de células T responsivas ao tumor, especialmente após o bloqueio dos receptores PD-1/PD-L1. Além disso, pesquisas sugerem que a força de estimulação do TCR pode influenciar a formação de Tpex. Estímulos fracos favorecem a formação de Tpex, enquanto estímulos fortes resultam na formação de células Tex. Esse fenômeno foi observado em infecções virais, mas o impacto dessa dinâmica no câncer ainda é uma questão em aberto.
Recentemente, um estudo investigou esse impacto, utilizando epítopos alterados do vírus da coriomeningite linfocítica (LCMV), conhecidos como M9 e o C6M9, para gerar diferentes intensidades de ativação do TCR em células CD8+ Gp33 específicas. Camundongos foram implantados com células tumorais que expressavam esses epítopos e, após 6 dias, receberam células T CD8+ específicas para Gp33. Após 4, 8 e 12 dias, foi observado que a ativação robusta do TCR (M9) resultou em uma grande expansão das células T CD8+ específicas para Gp33 nos linfonodos drenantes (tdLN) dos camundongos. Em contraste, a ativação mais fraca (C6M9) não gerou a mesma resposta expansiva. Além disso, a ativação forte favoreceu a formação e manutenção das Tpex nos TdLN por até 12 dias, enquanto as Tpex induzidas pela ativação fraca diminuíram com o tempo. Esse fenômeno também foi observado no microambiente tumoral, onde o bloqueio farmacológico da migração de linfócitos prejudicou a manutenção das Tpex.
As células Tpex e Tex apresentam diferenças marcantes em seus perfis transcricionais, o que é sustentado por modificações epigenéticas distintas. O estudo também investigou se a força de estimulação do TCR determina o perfil epigenético adotado pelas células T. As células T ativadas fortemente e fracamente se distinguiram em relação à acessibilidade à cromatina, com diferentes assinaturas epigenéticas observadas em células isoladas do tumor. Genes regulados por TCF1 diferiram não apenas em função da força de estimulação de TCR, mas também do nicho ocupado pelo células, visto que a sobreposição de regiões de cromatina aberta entre células oriundas do tdLN e do tumor foi mínima. Genes regulados por TCF1 estavam aumentados nas Tpex fortemente estimuladas, enquanto vias associadas à apoptose estavam enriquecidas nas Tpex com estimulação fraca.
Um dos genes de interesse foi Slamf6, que codifica o Ly108, uma molécula importante para a formação das Tpex. Após a ativação forte do TCR, o Slamf6 foi amplamente ativado, sugerindo que o TCF1 se liga ao promotor do Slamf6, induzindo sua expressão e promovendo a formação de Tpex. Para testar essa hipótese, os pesquisadores criaram células T CD8+ Gp33 específicas com uma deleção no promotor de Slamf6. Embora a expressão de Ly108 tenha sido reduzida, a população de Tpex não foi afetada, sugerindo que, apesar da regulação de Slamf6, a interação entre TCF1 e Slamf6 não é essencial para a formação das Tpex.
Esse estudo revela que a ativação forte de TCR gera um perfil epigenético que favorece a formação de Tpex, células essenciais para a resposta a terapias imunológicas, como a inibição de check points imunológicos. As Tpex se mantém com alta capacidade proliferativa nos linfonodos drenantes do tumor (tdLN) e continuam migrando para o microambiente tumoral para repovoá-lo. Em contrapartida, a estimulação fraca compromete a formação contínua de Tpex, limitando a eficácia da terapia no longo prazo (Fig. 1).



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










