Por: Rafaela Mano Guimarães e Danilo Machado (doutorandos IBA/FMRP-USP)
Editora: Luciana Benevides
Pode-se observar claro dimorfismo sexual quanto a susceptibilidade, frequência e severidade de infecções entre homens e mulheres. Este dimorfismo está influenciado por genética, biologia e ambiente em que as pessoas se encontram, incluindo-se a exposição e o tipo/espécie de agentes infeciosos, exposição a hormônios esteroides e receptores estimulados, e consequentemente a resposta imune que é montada e dirigida a estes agentes patogênicos (1).
De forma geral, os homens são mais suscetíveis a infecções bacterianas pela natureza supressora da testosterona na resposta imune, levando a uma limitada resposta pró-inflamatória, o que pode contribuir para a persistência de infecções. Já as mulheres produzem dois hormônios esteroides, o estradiol e a progesterona. O estradiol é um ativador, contribuindo para o controle e a disseminação do agente patogênico, que quando excessivo, pode levar ao agravamento da doença. Enquanto a progesterona possui um papel modulador do sistema imune suprimindo a resposta imune (2).
Em infecções por bactérias que colonizam o trato gastrointestinal pode ocorrer dano ou disfunção do epitélio intestinal, o que permite a translocação de microrganismos do intestino para a corrente sanguínea, o que pode levar ao fígado, que tem importante papel na detecção e depuração desses microrganismos. Os macrófagos residentes do fígado, as células de Kupffer, reconhecem microrganismos opsonizados por moléculas do sistema complemento (C3b), mediados por meio de receptores CR, Fc ou ainda receptores CRIg. Os receptores CRIg compõe um mecanismo determinante na captura de bactérias Gram-negativas, mas também na captura de bactéria Gram-positivas. Os anticorpos naturais produzidos por linfócitos B1 são em sua maioria IgM, mas ainda IgG3 e IgA e tem papel importante na resposta imune: neutralização, ativação de sistema complemento, ADCC, fagocitose de células em apoptose, prevenção de autoimunidade e opsonização e mostra-se importante na captura e controle de microrganismos patogênicos (3,4,5).
Sabendo-se disso, o objetivo do trabalho foi demonstrar quais são os mecanismos imunes envolvidos nas respostas contra bactérias, mais especificamente a E. coli que permite que as fêmeas sejam mais resistentes à infecção do que os machos. A rápida eliminação das bactérias presentes na circulação é essencial para proteção do organismo, sendo esse processo realizado principalmente por células de Kupffer no fígado. Essas células podem reconhecer a bactéria através de seus vários receptores que se ligam direta ou indiretamente via anticorpo ou a fragmentos do complemento, como C3 (3). Assim, embora machos e fêmeas selvagens tenham a capacidade de capturar e eliminar as bactérias presentes na circulação, a retirada do C3 faz com as células de Kupffer de camundongos machos percam a capacidade de capturar o microorganismo, no caso a E. coli, enquanto que as fêmeas deficientes para o C3 respondem normalmente a infecção, eliminando a bactéria. Dessa forma, qual seria o mecanismo de eliminação das bactérias nas fêmeas, o qual se faz independente do complemento?
O trabalho publicado na Nature Immunology (6) demonstra que o estrogênio, produzido por camundongos fêmeas na puberdade, estimula macrófagos peritoneais a expressarem citocinas como IL-10, BAFF e APRIL4 e essas ativam as células B-1 peritoneais a produzirem anticorpos naturais (nAbs) que são específicos para o antígeno O127 do LPS presente na membrana das E. coli. Curiosamente, a produção desses anticorpos, parece não requerer exposição prévia ao antígeno. Assim, após a infecção sistêmica com uma cepa de E. coli que expressa LPS O127, camundongos fêmeas apresentam depuração acelerada dessas bactérias em relação à de camundongos machos. Isso se deve ao reconhecimento do antígeno O expresso na superfície por esses nAbs, que promovem a captura eficiente de bactérias circulantes pelas células de Kupffer. Com isso, a presença destes nAbs confere proteção contra uma dose letal de EPEC e pode ser transferida e proteger a prole (Figura 1).
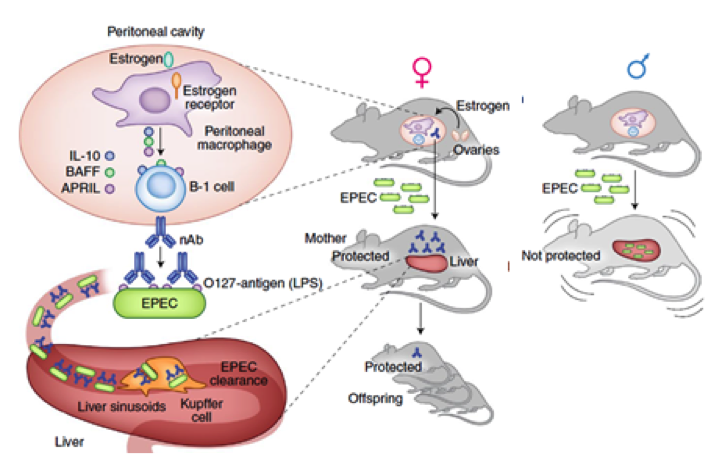
Figura 1. Camundongos fêmeas produzem anticorpos naturais estimulados por estrógeno que promovem a proteção contra infecções por E. Coli.
Referências:
1- LAUPLAND, Kevin B. Incidence of bloodstream infection: a review of population-based studies. Clinical microbiology and infection, v. 19, n. 6, p. 492-500, 2013.
2- VÁZQUEZ-MARTÍNEZ,E. R. et al. Sexual dimorphism in bacterial infections. Biology of Sex Differences. v. 9:27, 2018.
3- KUBES, P; JENNE, C. Immune Responses in the Liver. Immunol. v. 36, p.247–77, 2018.
4- PANDA, S.; DING, J. L. Natural Antibodies Bridge Innate and Adaptive Immunity. J Immunol. v. 194, p.13-20, 2015.
5- SUBRAMANIAM, K. S. et al. The Absence of Serum IgM Enhances the Susceptibility of Mice to Pulmonary Challenge with Cryptococcus neoformans. J Immunol. v. 184, p. 5755-5767. 2010.
6- ZENG, Z. et al. Sex-hormone-driven innate antibodies protect females and infants against EPEC infection. Nature Immunology. v. 19, p. 1100-1111. 2018.
- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










