Autores: Mahugnon Léger Erasme Gbaguidi e Jefferson Elias-Oliveira
Editado por: Profa. Dra. Vanessa Carregaro
Referência: Wypych, T.P., Pattaroni, C., Perdijk, O. et al. Microbial metabolism of L-tyrosine protects against allergic airway inflammation. Nat Immunol 22, 279–286 (2021). https://doi.org/10.1038/s41590-020-00856-3
A asma é uma das doenças pulmonares crônicas mais prevalentes no mundo, e possui como principais características a inflamação pulmonar, a broncoconstrição e a produção excessiva de muco, decorrentes de uma desregulação entre epitélio das vias áreas e sistema imunológico (Lambrecht; Hammad, 2012). É bastante comum que crianças asmáticas apresentem sensibilização à alérgenos inalados, como ácaros do pó doméstico (HDM), esporos fúngicos ou pólen (Lloyd, 2009). O receptor TLR4 (Toll-like receptor 4), expresso nas células epiteliais das vias áreas, funciona como um sensor para esses alérgenos, induzindo citocinas que ativam células dendríticas (DCs), que por sua vez promovem a geração de linfócitos do perfil Th2 específicos para o alérgeno (Hammad, 2009; Willart, 2012). Os linfócitos com assinatura Th2 produzem citocinas como IL-5, IL-4 e IL-13, responsáveis pela eosinofilia, produção de IgE e hiperresponsividade das vias aéreas, eventos marcantes na asma (Lloyd, 2009). De maneira interessante, uma dieta rica em fibras, o consumo de leite de vaca não pasteurizado e a amamentação foram relacionados com proteção no desenvolvimento da asma, provavelmente por modular a composição da microbiota e o metabolismo microbiano (Wypych; Marsland, 2017; Valdes, 2018). Porém, tais mecanismos ainda não estão claros.
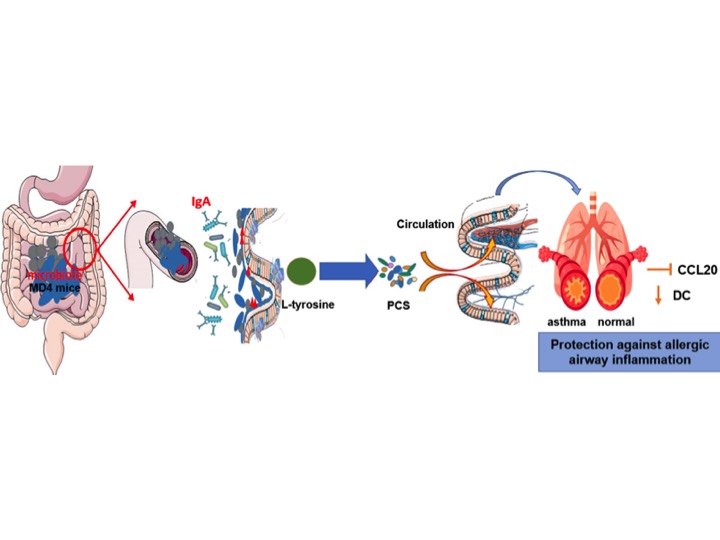
Sabe-se que fatores intrínsecos do indivíduo também podem modular a microbiota, como a diversidade de anticorpos (Fransen, 2015). Nesse sentido, tentando elucidar vias que poderiam modular a asma, Wypych e colaboradores (2021), da Universidade Monash, de Melbourne (Austrália), investigaram o impacto de um repertório de anticorpos restrito à composição da microbiota intestinal e seus efeitos no processo inflamatório na asma experimental. Os camundongos MD4 possuem mais de 99% de suas células B específicas para a lisozima do ovo de galinha, e por isso, foram usados como modelo de restrição da diversidade de anticorpos. Após sensibilização e desafios intranasais com HDM, os pesquisadores observaram que os camundongos MD4 apresentavam menos eosinófilos e DCs nos pulmões, além de diminuição no número de células caliciformes e no infiltrado inflamatório peribronquial, quando comparado ao grupo selvagem. Buscando entender se a microbiota estaria envolvida nessa proteção, a sequência de amplicons do gene 16S foi analisada nas fezes dos animais, e como esperado, a composição da microbiota diferia entre os camundongos MD4 e selvagens.
Para determinar se as diferenças nas comunidades bacterianas poderiam estar relacionadas com o desenvolvimento da asma, os pesquisadores utilizaram a estratégia de co-housing. Neste experimento, camundongos germ-free (GF) foram co-alojados com camundongos do tipo selvagem ou MD4 por 6 semanas, após os quais foram expostos a HDM. Foi observado que ocorria a transferência da microbiota MD4 para camundongos “GF-MD4”, e assim estes animais tornavam-se protegidos da inflamação alérgica das vias aéreas induzida por HDM. Além disso, os pesquisadores observaram maior abundância de bactérias revestidas com IgA secretória nas fezes dos camundongos MD4, quando comparado ao grupo selvagem. Sabendo que a microbiota possui efeitos imunomoduladores via liberação de metabólitos na circulação, os autores do estudo avaliaram o metaboloma dos camundongos, e de maneira interessante, o metabólito sulfato de p-cresol (PCS) estava altamente enriquecido no plasma de animais MD4. PCS é o produto sulfatado do p-cresol, gerado por bactérias a partir do metabolismo da L-tirosina no cólon. As análises de metagenômica mostraram que o gene thiH, que codifica a enzima 2-iminoacetato sintase, responsável pela conversão de L-tirosina em p-cresol, mapeado na espécie Prevotella MGM1, estava bastante aumentada nas fezes de camundongos MD4, sugerindo que essa linhagem possui maior capacidade de utilizar a L-tirosina da dieta.
Curiosamente, e de maneira semelhante aos primeiros resultados, tanto a administração da L-tirosina como a do PCS foram capazes de proteger contra a inflamação alérgica induzida por HDM em camundongos selvagens. Em relação ao mecanismo, os pesquisadores demonstraram que a L-tirosina e PCS inibiam a produção da quimiocina CCL20 nas células epiteliais pulmonares, provavelmente por meio do desacoplamento de TLR4 e cross-talk com o receptor do fator de crescimento epidérmico (EGFR), levando, assim, a uma redução no recrutamento de DCs no contexto da inflamação pulmonar. Com esses achados, a pesquisa evidencia a existência de uma nova via no eixo intestino-pulmão, que poderia ser direcionada na terapia para tratar ou prevenir doenças inflamatórias alérgicas.
Referências
Lambrecht, B. N. & Hammad, H. The airway epithelium in asthma. Nat. Med. 18, 684–692 (2012).
Lloyd, C. Dust mites' dirty dealings in the lung. Nat Med 15, 366–367 (2009).
Hammad, H. et al. House dust mite allergen induces asthma via Toll-like receptor 4 triggering of airway structural cells. Nat. Med. 15, 410–416 (2009).
Willart, M. A. et al. Interleukin-1α controls allergic sensitization to inhaled house dust mite via the epithelial release of GM-CSF and IL-33. J. Exp. Med. 209, 1505–1517 (2012).
Wypych, T. P. & Marsland, B. J. Diet hypotheses in light of the microbiota revolution: new perspectives. Nutrients 9, 537 (2017).
Valdes, A. M., Walter, J., Segal, E. & Spector, T. D. Role of the gut microbiota in nutrition and health. Brit. Med. J. 361, k2179 (2018).
Fransen, F. et al. BALB/c and C57BL/6 mice differ in polyreactive IgA abundance, which impacts the generation of antigen-specific IgA and microbiota diversity. Immunity 43, 527–540 (2015).
Wypych, T.P., Pattaroni, C., Perdijk, O. et al. Microbial metabolism of L-tyrosine protects against allergic airway inflammation. Nat Immunol 22, 279–286 (2021).

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










