Autoras: Thaílla Pacheco e Rafaela Souza
Editor: Ademilson Panunto Castelo
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
Em um estudo intitulado “A bladder-blood immune barrier constituted by suburothelial perivascular macrophages restrains uropathogen dissemination”, publicado no periódico Immunity, em março de 2025, Lu Li e cols. investigaram um subconjunto de macrófagos perivasculares suburoteliais na bexiga que exercem uma função de barreira imunológica fundamental para prevenir a disseminação bacteriana sistêmica durante a cistite aguda.1
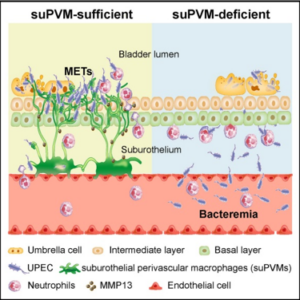
A sepse é atualmente uma das principais causas de morte e a primeira em termos de readmissões hospitalares no mundo, sendo responsável por cerca de 20% de todas as mortes globais, segundo estimativas da Organização Mundial da Saúde.2 Esse tipo de condição pode se iniciar em qualquer parte do corpo; contudo, os focos infecciosos mais comuns incluem os pulmões, o trato urinário e a cavidade abdominal. As infecções do trato urinário inferior (ITUs) são um problema de saúde comum que afeta milhões de pessoas em todo o mundo.3 Essas infecções ocorrem quando bactérias, em especial a Escherichia coli uropatogênica (UPEC), entram no trato urinário, causando inflamação e desconforto. Os rins, os ureteres, a bexiga e a uretra compõem o sistema urinário, sendo a uretra e a bexiga as partes mais comumente infectadas.4 A bexiga compreende camadas distintas, incluindo a adventícia (ou serosa nas porções peritoneais), a muscular própria, a lâmina própria e um revestimento interno de epitélio (urotélio).5 Estudos recentes demonstraram que a bexiga contém uma densa rede de células imunitárias residentes no tecido dentro da lâmina própria e muscular.6 À vista disso, o presente estudo identificou um subconjunto especializado de macrófagos perivasculares suburoteliais (suPVMs) na bexiga, que atua como uma barreira imunológica fundamental para prevenir a disseminação sistêmica de uropatógenos durante infecções do trato urinário (ITUs). Utilizando modelo murino, os autores demonstraram que os suPVMs estão estrategicamente localizados junto a capilares da lâmina própria. Na fase inicial da infecção por UPEC, os suPVMs são capazes de passar por mudanças morfológicas e funcionais que os capacitam a capturar ativamente as bactérias que invadiram a lâmina própria e preservar a integridade vascular. A depleção seletiva desses suPVMs resultou em bacteremia e perda da integridade endotelial, sugerindo importância crítica dessas células na contenção da infecção. Durante a progressão da cistite aguda, os suPVMs sofrem um processo chamado METose, semelhante à NETose observada em neutrófilos, liberando armadilhas extracelulares de DNA de macrófagos (METs) para o urotélio. Essas estruturas atuam como redes físicas que aprisionam as bactérias dentro do urotélio, impedindo sua migração para camadas subepiteliais e, consequentemente, para a corrente sanguínea. A ausência de METs, seja por inibição farmacológica, manipulação genética ou depleção dos suPVMs, levou a uma maior translocação bacteriana para a lâmina própria da bexiga e disseminação sistêmica dessas bactérias. Além disso, foi mostrado que a metaloproteinase-13 (MMP13), liberada juntamente com as METs, facilita a migração transuroepitelial de neutrófilos, uma vez que essa enzima é capaz de degradar componentes da matriz extracelular e permitir a passagem dessas células até o foco da infecção. A morte desses macrófagos via METose, embora reduza temporariamente a função de barreira imunológica, é compensada por uma rápida reposição advinda da migração de monócitos circulantes, que readquirem competência funcional para conferir proteção contra ITUs recorrentes. Em conclusão, o trabalho revela uma função inédita dos suPVMs como formadores de uma barreira imunológica entre a bexiga e o sangue. Esses achados fornecem novas perspectivas sobre os mecanismos de contenção de uropatógenos e prevenção da urossepsia, com possíveis implicações terapêuticas para o manejo de ITUs recorrentes.
Resumo gráfico - Armadilhas de DNA extracelular de macrófagos protegem o hospedeiro da disseminação bacteriana a partir do urotélio. A bexiga abriga uma densa rede de macrófagos perivasculares suburoteliais (suPVMs) associados ao endotélio. Durante infecções do trato urinário, suPVMs previnem bacteremia e disseminação sistêmica da E. coli uropatogênica (UPEC), por meio da projeção de armadilhas de DNA extracelular (METs) no urotélio, as quais capturam as bactérias. A metaloproteinase-13 (MMP13), associada às METs, facilita a migração de neutrófilos através do urotélio, promovendo a depuração bacteriana. Na ausência dos suPVMs, essa depuração bacteriana e a migração de neutrófilos não ocorrem, favorecendo a disseminação de UPEC para outros tecidos, predispondo o hospedeiro a sepse.
Referências
- Li L, Jiao Q, Yang Q, et al. A bladder-blood immune barrier constituted by suburothelial perivascular macrophages restrains uropathogen dissemination. Immunity 2025; 58: 568-584.e6.
- Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the Global Burden of Disease Study. The Lancet 2020; 395: 200–211.
- Siqueira-Batista R, Gomes AP, Calixto-Lima L, et al. Sepse: atualidades e perspectivas. Rev Bras Ter Intensiva 2011; 23: 207–216.
- National cancer institute. Urinary tract infection. https://www.cancer.gov/publications/dictionaries/cancer-terms/def/urinary-tract-infection.
- Sharma S, Basu B. Biomaterials assisted reconstructive urology: The pursuit of an implantable bioengineered neo-urinary bladder. Biomaterials 2022; 281: 121331.
- Bowyer GS, Loudon KW, Suchanek O, et al. Tissue Immunity in the Bladder. Annu Rev Immunol 2022; 40: 499–523.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)