Por: Bruno Marcel e Allana F. Da Costa Pessoa (doutorandos IBA-FMRP/USP)
Editora: Luciana Benevides
Vários trabalhos têm demonstrado uma comunicação entre o sistema nervoso e o sistema imune (1). No sistema digestivo, monócitos e mastócitos estão sob controle do sistema nervoso entérico, ambos atuando em conjunto para o controle do peristaltismo gastrointestinal (2). Além disso, tem sido demonstrado que macrófagos e linfócitos T podem ser estimulados por catecolaminas oriundas do sistema nervoso simpático (2,3). Em estudos recentes, a estimulação do nervo vago diminuiu a atividade pró-inflamatória de macrófagos por meio da ligação de catecolaminas a receptores β-adrenérgicos em linfócitos T (4). Na hematopoiese, a sinalização adrenérgica também atua promovendo a mobilização de células precursoras de monócitos para tecidos inflamados (5). No entanto, pouco se sabe sobre o papel do sistema nervoso simpático na diferenciação de células mielóides em condições inflamatórias. Nesse estudo (6) foi demonstrado que a mielopoiese no baço pode ser regulada pelo sistema nervoso simpático, no contexto de diabetes. Os leucócitos, monócitos e monócitos inflamatórios estão correlacionados positivamente com altas concentrações de norepinefrina, no soro de pacientes com diabetes do tipo 1. Além disso, foi demonstrado que a diabetes induz o aumento da diferenciação de células progenitoras granulocíticas e monocíticas (GMP) no baço, a partir de neurônios e de células mielóides esplênicas, por um mecanismo dependente da produção de catecolaminas e de receptores adrenérgicos do tipo 2 (Figura).
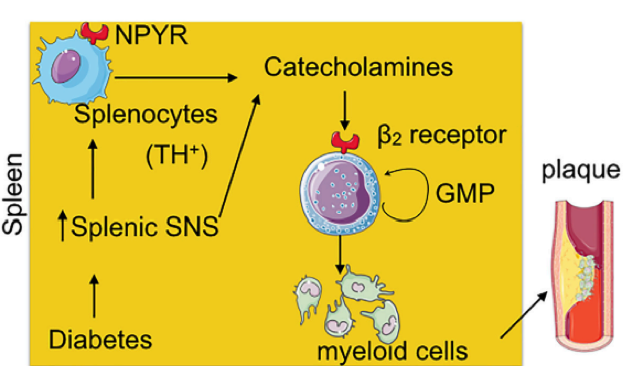
Figura: No contexto da diabetes, nervos esplênicos regulam a expressão de células mielóides tirosina hidroxilase+ (TH+), que aumentam a expressão de receptores de neuropeptídeos como o NPYR. Tanto os neurônios e células mielóides esplênicas produzem catecolaminas, que atua em receptores adrenérgicos do tipo beta 2, e induz a diferenciação de células progenitoras granulocítica-monocítica em células mielóides que contribuem para a inflamação e deposição de lipídeos em modelo de aterosclerose.
Referências
1. Veiga-Fernandes, Henrique, and Vassilis Pachnis. “Neuroimmune regulation during intestinal development and homeostasis.” Nature immunology 18.2 (2017): 116.
2. Muller, Paul Andrew, et al. “Crosstalk between muscularis macrophages and enteric neurons regulates gastrointestinal motility.” Cell158.2 (2014): 300-313.
3. Andersson, Ulf, and Kevin J. Tracey. “Neural reflexes in inflammation and immunity.” Journal of Experimental Medicine209.6 (2012): 1057-1068.
4. Wang, H., Yu, M., Ochani, M., Amella, C.A., Tanovic, M., Susarla, S., Li, J.H.,Wang, H., Yang, H., Ulloa, L., et al. “Nicotinic acetylcholine receptor alpha7 subunit is an essential regulator of inflammation”. Nature 421 (2003): 384–388.
5. Scheiermann, Christoph, et al. “Adrenergic nerves govern circadian leukocyte recruitment to tissues.” Immunity37.2 (2012): 290-301.
6. Vasamsetti, Sathish Babu, et al. “Sympathetic neuronal activation triggers myeloid progenitor proliferation and differentiation.” Immunity 49.1 (2018): 93-106.

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










