Autores: Gabriela Crispim Baiocchi e Luiz Felipe L. de Araujo
Editado por: Vânia Bonato
Referência: CHEN, Zuojia et al. Interleukin-33 Promotes Serotonin Release from Enterochromaffin Cells for Intestinal Homeostasis. Immunity, v. 54, n. 1, p. 151- 163.e6, 2021.
Células enterocromafins (EC) são um tipo especializado de células epiteliais intestinais capazes de produzir serotonina (5-HT) em resposta a microbiota intestinal, estimulação mecânica, e metabólitos (BELLONO et al., 2017).
Embora o papel das células enterocromafins no reconhecimento de estímulos ambientais e produção de 5-HT para homeostase seja descrito na literatura, pouco se sabe sobre o reconhecimento de sinais imunológicos e indução de respostas neuroendócrinas (CHEN et al., 2021). Desse modo, o trabalho de Chen et al., publicado na Immunity em janeiro de 2021, buscou investigar IL-33, uma alarmina liberada mediante dano tecidual, que promove indução de resposta do tipo 2 e eliminação de parasitas (LIEW; GIRARD; TURNQUIST, 2016), avaliando o possível papel da IL-33 e das células enterocromafins na expulsão do parasita intestinal Trichuris muris.
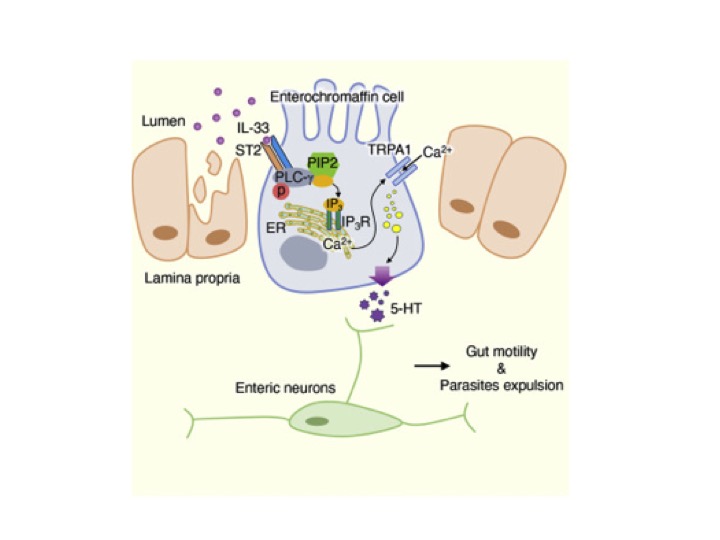
Em um estudo recente, haviam mostrado que a administração de IL-33 exógena conferia proteção a camundongos deficientes em resposta imune do tipo 2, que eram suscetíveis à infecção por T. muris, sendo a proteção dependente do aumento da motilidade intestinal, evidenciando assim uma potencial nova função da IL-33 no clearance parasitário independente de uma via do sistema imune. De modo a elucidar os subtipos celulares que respondiam a IL-33, foi realizada a deleção condicional de seu receptor, ST2, sendo possível observar a perda na motilidade intestinal apenas quando as células epiteliais tinham o receptor depletado. Tendo em vista a necessidade de neurônios entéricos para que ocorram movimentos peristálticos, foi testada a hipótese que as células epiteliais intestinais ativem os neurônios através da liberação de serotonina (5-HT) induzida por IL-33. Por meio da administração de IL-33 em camundongos com deleção da triptofano hidroxilase 1 (enzima necessária na síntese de 5-HT), não foi observada secreção de 5-HT e motilidade intestinal. Em consonância, os resultados sugeriam que a IL-33 promovia a motilidade induzindo a secreção de 5-HT por células epiteliais.
Como descrito em outros estudos, as células enterocromafins (EC) são a principal fonte de 5-HT na periferia (GERSHON, 2013; GERSHON; TACK, 2007). Com o objetivo de avaliar se estas células eram responsáveis pela produção de 5-HT induzidas por IL-33 no intestino, foram utilizados camundongos com deleção específica de ST2 em células EC (ChgacreER-GFPIl1rl1fl/fl), sendo possível observar a perda da capacidade de liberação de 5-HT após a administração de IL-33. Avançando na elucidação dos mecanismos moleculares envolvidos neste processo, os autores encontraram que apenas a sinalização do eixo IL-33-ST2 não era suficiente para a secreção de serotonina, sendo proposta a participação de um receptor sensorial em conjuntamente ao eixo IL33-ST2. Dentre os receptores presentes nas células enterocromafins, o potencial transitório do receptor anquirina 1 (TRPA1) apresenta sinergia com IL-33 na ativação e liberação de 5-HT. Em específico, foi identificada a cascata de sinalização intracelular entre IL-33-ST2 e TRPA1, onde a fosforilação da fosfolipase C-gama 1 (PLC-γ1) é necessária para liberar os estoques de Ca2+ intracelulares presentes no retículo endoplasmático para a ativação do TRPA1.
Por fim, buscando confirmar se tal processo era conservado em células humanas, os autores diferenciam células-tronco pluripotentes induzidas em organoides de células enterocromafins. Nas culturas de organóides, eles validam que em resposta a IL-33 ocorria aumento na fosforilação de PLC-γ1 e liberação de 5-HT, enquanto o bloqueio de TRPA1 reduzia a secreção de 5-HT. Em conclusão, o estudo mostra os mecanismos moleculares e celulares pelos quais a IL-33 induz a secreção de 5-HT por células EC no intestino.
BELLONO, Nicholas W.; BAYRER, James R.; LEITCH, Duncan B.; CASTRO, Joel; ZHANG, Chuchu; O’DONNELL, Tracey A.; BRIERLEY, Stuart M.; INGRAHAM, Holly A.; JULIUS, David. Enterochromaffin Cells Are Gut Chemosensors that Couple to Sensory Neural Pathways. Cell, v. 170, n. 1, p. 185- 198.e16, 2017.
CHEN, Zuojia et al. Interleukin-33 Promotes Serotonin Release from Enterochromaffin Cells for Intestinal Homeostasis. Immunity, v. 54, n. 1, p. 151- 163.e6, 2021.
GERSHON, Michael D. 5-Hydroxytryptamine (serotonin) in the gastrointestinal tract. Current Opinion in Endocrinology, Diabetes and Obesity, v. 20, n. 1, p. 14–21, 2013.
GERSHON, Michael D.; TACK, Jan. The Serotonin Signaling System: From Basic Understanding To Drug Development for Functional GI Disorders. Gastroenterology, v. 132, n. 1, p. 397–414, 2007.
LIEW, Foo Yew; GIRARD, Jean Philippe; TURNQUIST, Heth Roderick. Interleukin-33 in health and disease. Nature Reviews Immunology,, v. 16, n. 11, p. 676–689, 2016.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










