Autores: Nayara Pereira e Ualter Cipriano
Editor: Ademilson Panunto Castelo
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada USP/RP
Referência: Seok, J., Cho, S. D., Lee, J., et al. (2023). A virtual memory CD8+ T cell-originated subset causes alopecia areata through innate-like cytotoxicity. Nature Immunology, 24(11), 1308-1317. https://doi.org/10.1038/s41590-023-01547
O estudo intitulado “A virtual memory CD8+ T cell originated subset causes alopecia areata through innate-like cytotoxicity”, publicado na revista Nature Immunology, em junho de 2023, por Seok e cols., buscou identificar as funções patológicas de células T CD8+ de memória virtual (Tvm) no contexto de alopecia areata.
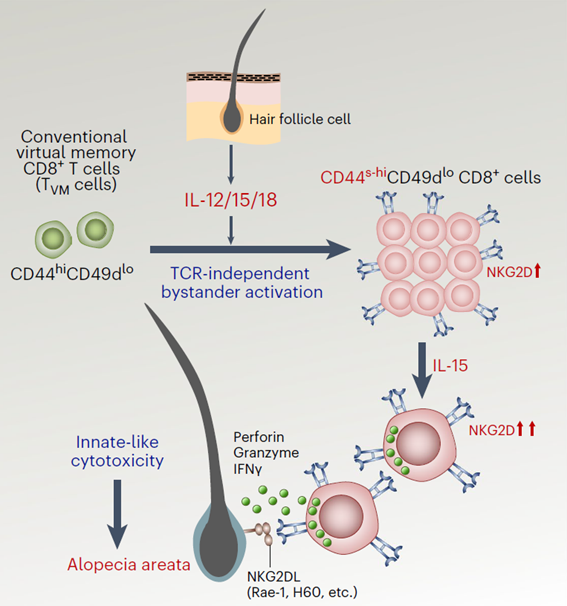
As células Tvm surgem baseadas em fenômeno chamado proliferação homeostática, que consiste na multiplicação de células T naive sem a necessidade de ativação via receptor antigênico de células T (TCR), formando uma população de células similares a de memória (memory-like).
O termo “memória” para um linfócito que não foi ativado por antígeno pode levar muitos imunologistas a torcerem o nariz (com razão!), mas a literatura justifica a nomenclatura, dentre outros motivos, pela capacidade de rápida proliferação e pela alta expressão de um receptor considerado um marcador de memória de células T, o CD44.
Para células CD8+, o título “memória virtual” foi dado pela capacidade dessas células estarem presentes no local da resposta imunológica e poderem contribuir para a inflamação, através da produção de citocinas e do recrutamento de outras células. Embora não tenham sido ativadas pelo TCR, essas células possuem atividades citotóxicas. O mecanismo para tal se dá através do receptor NKGD2 e a presença de um microambiente rico em interleucina (IL-) 12, IL-18 e IL-15, que permitem a proliferação e produção de IFN-γ por essas células.
Como as funções dessas células já tinham sido descritas em modelos de infecções e tumores, nessa pesquisa os cientistas buscaram compreender como as células Tvm se comportariam em um modelo de doença inflamatória, a alopecia areata. Essa doença é caracterizada pela queda de cabelo decorrente de autoimunidade e, por conseguinte, do processo inflamatório mediado por células T CD8 no folículo piloso, que resulta em locais específicos, normalmente círculos ou áreas na cabeça onde não há fios.
Os autores, ao utilizarem camundongos C3H/HeJ, que desenvolvem perda de pelos de forma espontânea e de um modo semelhante ao da alopecia areata, observaram um aumento significativo de células Tvm (CD44hi) na pele desses animais doentes quando comparado à pele de animais saudáveis. É interessante ressaltar que também observaram a existência de uma população de células Tvm expressando mais intensamente o marcador CD44, que denominaram de CD44super-hi. Os autores correlacionaram a intensidade da perda de pelos com a quantidade de células CD44super-hi, ou seja, quanto mais intensa a alopecia, mais células CD44super-hi existiam na pele inflamada.
Para comprovar o papel dessas células na indução de alopecia, os autores transferiram células Tvm CD44hi ou CD44super-hi de animais doentes para animais saudáveis e ambas as células induziram alopecia em animais saudáveis, sendo em maior grau em animais que receberam células CD44super-hi quando comparado aos animais que receberam células CD44hi. Como ambas as células apresentam as mesmas características, exceto a expressão mais intensa do marcador CD44, os autores presumiram que ambas apresentam a mesma origem.
Para testar essa hipótese, transduziram células Tvm CD44hi com retrovírus que expressa proteína fluorescente verde (GFP, green fluorescent protein) e procederam uma transferência adotiva dessas células para animais saudáveis C3H/HeJ. Assim, os autores observam que as células Tvm com alta expressão de CD44 (CD44hi) e que expressavam a GFP passaram a ter uma superexpressão do marcador (CD44super-hi), o que sugere que as células Tvm CD44super-hi são originadas de células Tvm CD44hi. Também mostraram que é necessário um ambiente inflamatório rico em citocinas, tais como IL-12, IL-15 e IL-18, para essas células se desenvolverem e proliferarem, o que se mostrou independente da sinalização por TCR.
A ativação e formação dessas células Tvm por citocinas inflamatórias aumentou a expressão do receptor NKG2D, típico de células natural killer, o que permitiu que essas células Tvm realizassem suas funções efetoras. É digno de nota que células Tvm CD44super-hi ativadas por citocinas passam também a expressar grânulos contendo granzimas e perforinas, que ao serem liberadas por desgranulação induzem apoptose em células-alvo. Além disso, produziram IFN-γ, que promove a ação inflamatória dessa célula. Os autores mostraram que essa ação é dependente da ligação feita pelo NKG2D à célula-alvo, determinando novamente que o processo é independente de TCR. Assim, a célula Tvm reconhece o ligante de NKG2D no folículo piloso, o que induz desgranulação e ação citotóxica, levando à destruição das células responsáveis pela formação do pelo e ao desenvolvimento da doença.
Resumo: Na presença de inflamação, citocinas como IL-12, IL-15 e IL-18 induzem a proliferação e diferenciação de células Tvm CD44hi em células CD44super-hi que passam a expressar NKG2D, um receptor que permite a função efetora e citotóxica das células Tvm. Essas células também passam a apresentar grânulos contendo granzimas e perforinas e a produzir IFN-γ. Células Tvm CD44super-hi reconhecem o ligante de NKG2D nos folículos pilosos, resultando em citotoxicidade da estrutura do folículo, característico na alopecia areata, o que é decorrente da degradação e liberação de granzimas e perforinas, bem como do processo inflamatório.
Referência:
Seok, J., Cho, S. D., Lee, J., et al. (2023). A virtual memory CD8+ T cell-originated subset causes alopecia areata through innate-like cytotoxicity. Nature Immunology, 24(11), 1308-1317. https://doi.org/10.1038/s41590-023-01547
Referências de apoio:
Jameson, S. (2002). Maintaining the norm: T-cell homeostasis. Nature Reviews Immunology, 2(7), 547-556.
Surh, C. D., & Sprent, J. (2000). Homeostatic T cell proliferation: how far can T cells be activated to self-ligands? Journal of Experimental Medicine. 192(4), F9–F14.
Lauvau, G., & Goriely, S. (2016). Memory CD8+ T Cells: Orchestrators and Key Players of Innate Immunity? PLoS Pathogens, 12(9), e1005722.
Seok, J., Cho, S. D., Seo, S. J., & Park, S. H. (2023). Roles of Virtual Memory T Cells in Diseases. Immune Network, 23(1), e11.
Haluszczak, C., Akue, A. D., Hamilton, S. E., Johnson, L. D., Pujanauski, L., Teodorovic, L., ... & Kedl, R. M. (2009). The antigen-specific CD8+ T cell repertoire in unimmunized mice includes memory phenotype cells bearing markers of homeostatic expansion. Journal of Experimental Medicine, 206(2), 435-448.
Pratt, C., King, L., Messenger, A., et al. (2017). Alopecia areata. Nature Reviews Disease Primers, 3, 17011.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)