Autores: Djúlio César Zanin e Mèdéton Mahoussi Michaël Boko
Editado por Vânia Bonato
Artigo: LIU, Z. et al. Glucocorticoid signaling and regulatory T cells cooperate to maintain the hair-follicle stem-cell niche. Nature Immunology, v. 23, p. 1086-1097, 2022
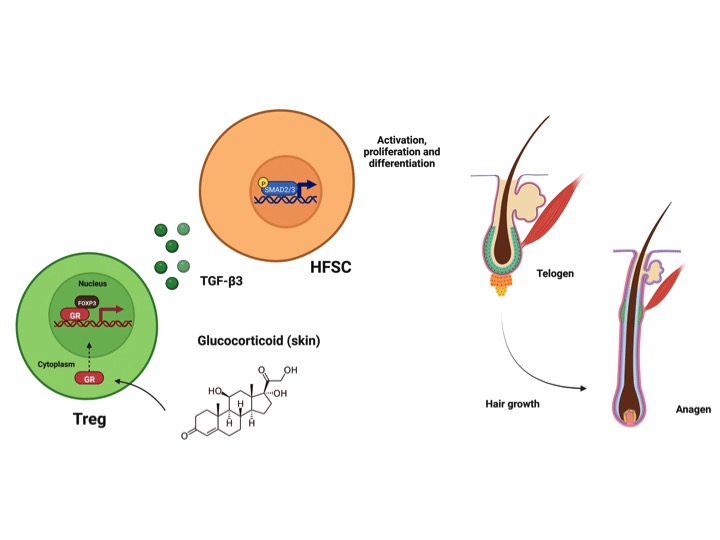
Células T reguladoras (Tregs) também estão envolvidas em contextos “não-imunológicos, como processos de reparo e regeneração tecidual1. Na pele, as Tregs localizam-se próximas ao folículo piloso (FP), estrutura responsável pela produção e crescimento de pelos e cabelo. Os FP abrigam células-tronco do folículo piloso (HFSCs) que estão constantemente recebendo sinais para permanecerem em repouso ou proliferarem e se diferenciarem, fases do “ciclo do cabelo”, conhecidas como telógena e anágena, respectivamente2. Durante a fase telógena, as Tregs são mais abundantes, mas sua eliminação reduz drasticamente o crescimento dos pelos, indicando sua importância para a regeneração do FP3. Hormônios esteroides como os glicocorticoides (GC) são sugeridos como um dos fatores-chaves para a atividade das Tregs4. De fato, estas moléculas, por meio de seu receptor (GR), exercem efeitos benéficos em Tregs de pacientes e em modelos experimentais5,6. Assim, Liu e colaboradores (2022), investigaram as funções dos GC e das Tregs para os processos de regeneração capilar.
Inicialmente, autores avaliaram a expressão de receptores de hormônios esteroides (incluindo Nr3c1: gene que codifica GR) nas Tregs em diferentes tecidos de camundongos. Na pele dos animais, observou-se um aumento da expressão de GR, sendo este resultado confirmado por citometria. Em seguida, utilizando-se de modelo químico de depilação (que induz a transição telógena-anágena), foram observados maiores níveis de GC (corticosterona, análogo murino do cortisol) na pele pós-depilação, indicando a produção local da molécula.
A fim de investigar a sinalização de GC nas Tregs, animais deficientes do receptor nestas células (Nr3c1ΔTreg) foram submetidos à depilação e, após 15 dias, constatou-se prejuízos ao crescimento dos pelos, com menor comprimento e disfunções na estrutura dos FP. Nestes animais, também foi verificado que a proliferação das HFSCs estava diminuída. Em seguida, com o RNA-seq das HFSCs, os autores observaram que havia regulação negativa de genes associados com a proliferação, diferenciação e morfogênese do epitélio nos animais Nr3c1ΔTreg. O RNA-seq das Tregs, por sua vez, demonstrou que nos animais controle - ao contrário dos Nr3c1ΔTreg - havia a regulação positiva de múltiplos genes, dentre eles, Tgfb3, sugerindo que as Tregs residentes da pele produzem fatores que afetam diretamente as HFSCs.
Através de ferramentas de bioinformática, observou-se que vias de comunicação entre Tgfb3 (expresso pelas Tregs) e diferentes moléculas expressas pelas HFSCs eram altamente enriquecidas nos animais controle. Com isso, os autores avaliaram se a expressão de TGF-β3 pelas Tregs seguiria o mesmo curso de tempo de indução de GC após a depilação. De fato, a expressão de Tgfb3 foi significativamente elevada nas Tregs da pele, mas não em células T CD4+ convencionais pós-depilação. Para entender ainda mais o mecanismo molecular que regulava a expressão de Tgfb3 nas Tregs, os autores trataram Tregs do baço com dexametasona (DEX) e demonstraram o aumento da expressão de TGF-β3 depois do tratamento. Ensaios de imunoprecipitação de cromatina comprovaram que pós-exposição a DEX, o GR e Foxp3 se ligavam conjuntamente em regiões semelhantes do DNA, incluindo o promotor de Tgfb3, indicando a cooperação para a regulação da transcrição.
Os autores então examinaram a sinalização de TGF-β frente à sinalização inibidora de proteínas morfogênicas ósseas (BMPs) nas HFSCs7. Nos animais Nr3c1ΔTreg, a fosforilação de Smad1 e 5 (ligados à via de BMP) foi constante, sugerindo que as HFSCs permanecem sob estado de quiescência na ausência da produção de TGF-β3 pelas Tregs. Por fim, animais controle tratados com anticorpo contra TGF-β3, apresentaram menor crescimento capilar. Por sua vez, o tratamento com TGF-β3 recombinante o restabelecia o crescimento dos pelos e a proliferação das HFSCs. In vitro, o co-cultivo de Tregs e HFSCs induzia a formação de colônias de HFSCs, um efeito bloqueado com a adição de anticorpo contra TGF-β3 no meio de cultura.
Em resumo, os resultados trazem novas compreensões sobre o papel da sinalização de glicocorticoides nas células T reguladoras e de sua importância para a manutenção das células-tronco do folículo piloso em condições de homeostase (Figura 1). Assim, crescem as evidências do envolvimento das Tregs em demais processos fisiológicos e não somente aqueles envolvidos com a resposta imunológica clássica. Além disso, os autores também mostraram a atividade e a importância de uma isoforma não tão conhecida de TGF, o TGF-β3, no folículo piloso. Com isso, o trabalho destaca as funções dos glicocorticoides sob um braço regulador do sistema imunológico no crescimento de pelos/cabelo, o que também abre espaço para investigações em distúrbios neste contexto, como a alopecia areata e os efeitos do stress (via cortisol) no microambiente capilar.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










