Autores: Priscila Correa e Samuel Oliveira
Editora: Beatriz R. Ferreira
Journal Club PPG Imunologia Básica e Aplicada – FMRP-USP
Quando se discute a imunidade antitumoral é imprescindível salientar a importância das células TCD8+, as quais estão sempre presentes em infiltrados tumorais com bom prognóstico (Chraa et al 2019). A citotoxicidade das células TCD8+ é desencadeada principalmente pelo receptor de células T (TCR), que reconhece antígenos tumorais específicos apresentados por moléculas do complexo de histocompatibilidade de classe I (MHC-I) presentes na superfície celular de células apresentadoras de antígenos (APCs) (Hollingsworth e Jansen 2019). No entanto, muitas vezes, os tumores escapam do sistema imunológico ao inativar as APCs, inibir a infiltração de TCD8+ no tecido tumoral e/ou suprimir ativação de células T (Spranger e Gajewsky et al. 2018).
Em especial, a diminuição da expressão do MHC-I é um mecanismo comum utilizado por tumores para escapar da resposta por células TCD8+ (Cornel et al. 2020). Glioblastomas (GMB), um tipo de tumor cerebral maligno, parecem saber disso, pois foi constatado que a expressão dessas moléculas estava ausente na superfície celular de 85,7% das biópsias tumorais de pacientes (Butt et al 2023). Além da redução da expressão do MHC-I, as células que compõem o microambiente de tumores sólidos, como o GMB, apresentam um perfil extremamente exausto, caracterizado pela expressão de moléculas inibidoras como PD-1 e TIM-3. Em resposta a terapias com anticorpos bloqueadores dessas moléculas, os pacientes contrapõem com a elevação compensatória de outras moléculas, tornando-os resistentes a esses tratamentos (Koyama et al 2016; Woroniecka et al 2016).
Devido a essa particularidade, novas alternativas terapêuticas têm sido investigadas. Recentemente, o grupo de Woroniecka e colaboradores (2020) identificou que a administração de um agonista (anti-H-2BB) de moléculas coestimuladoras 4-1BB-L, pertencente à superfamília de receptores do fator de necrose tumoral (TNFRSF), em conjunto com anti-PD-1, revelou ser uma opção promissora para melhorar de animais com GMB. Essa melhora era dependente de células TCD8+, conforme identificado por Woroniecka et al. (2023), que não só compreenderam o papel citotóxico de células TCD8+ em um contexto tumoral com baixa expressão de moléculas do MHC-I, mas também identificaram as vias utilizadas.
Inicialmente, os pesquisadores inocularam camundongos com uma linhagem tumoral de GMB, que sabidamente era incapaz de expressar MHC-I e os trataram com a imunoterapia combinada anti-PD-1 e anti-H-2BB, levando a uma melhora expressiva, conforme esperado. Conhecendo a importância de células Natural Killer (NK) no controle tumoral, eles depletaram essas células nos camundongos e não observaram redução na capacidade dos animais de eliminar o tumor. Assim, concluíram que essas células provavelmente não são importantes para explicar o mecanismo de ação da imunoterapia. Por outro lado, ao eliminaram células T CD8+, os camundongos perderam a capacidade de responder à imunoterapia, evidenciando a importância dessa população celular na imunidade ao tumor, mesmo na ausência de apresentação de MHC-I pelas células tumorais.
Apesar da ausência do MHC-I na linhagem de câncer utilizada, foi realizada a avaliação da relevância da especificidade antigênica neste contexto. Para isso, camundongos TCD8 knock-outs (que não possuem células T CD8+) receberam células tumorais sem expressão de MHC-I, mas com a expressão de um peptídeo imunogênico, o TRP2. Ao receberem a transferência adotiva de células TCD8+ transgênicas, as quais expressavam TCR específico para o peptídeo TRP2, os animais eliminaram o tumor e tiveram 100% de sobrevida, enquanto aqueles inoculados com tumores sem TRP2 perderam a capacidade de combater a massa tumoral e morreram. Assim, mesmo na ausência de apresentação de antígeno pela célula tumoral, a especificidade antigênica mostrou ser um requisito importante para a ativação de células TCD8+ para matar células tumorais sem expressão de MHC-I.
Uma vez que a ativação antígeno específica de células TCD8+ estava ocorrendo, foi identificado que macrófagos pulsados com TRP2 e cocultivados com células tumorais que expressavam TRP2, mas não expressavam MHC-I e células TCD8+ específicas para TRP2 eram capazes de induzir a ativação das células TCD8+ e sua atividade citotóxica frente às células tumorais in vitro. Já in vivo, os autores mostraram que ao pulsar macrófagos com TRP2 e, em seguida, inoculá-los dentro do tumor MHC-I negativo, é uma estratégia que permite que a resposta antitumoral induzida pela imunoterapia funcione, fazendo com que estes camundongos sobrevivam por mais tempo, quando comparados a camundongos inoculados com macrófagos pulsados com um antígeno não relacionado, como a ovalbumina (OVA), por exemplo.
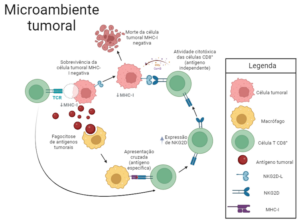
Sabendo que os macrófagos são importantes para a ativação prévia e específica das células TCD8+, levantou-se a questão de como essas células reconheceriam e matariam as células tumorais que não expressam MHC-I. Após a avaliação do perfil transcricional de células únicas de linfócitos OT-I (células TCD8+ que expressam um TCR transgênico específico para OVA) cocultivados com macrófagos pulsados com OVA na presença de células tumorais MHC-I negativas, observou-se uma expressão significativamente aumentada do gene Klrk, que codifica o MHC não clássico NKG2D. De maneira interessante, esse é um receptor clássico de células NK e está diretamente associado à sua atividade citotóxica, tornando-o um possível mediador da interação entre a célula TCD8+ e a célula tumoral MHC-I negativa.
Para concluir o estudo, os pesquisadores induziram o glioma em camundongos, seguido por tratamento imunoterápico descrito anteriormente em conjunto com um anticorpo bloqueador da atividade do NKG2D. Observou-se uma perda da capacidade de resposta ao tumor. Dessa forma, os autores concluíram que esta é a via responsável pela manutenção da resposta citotóxica no contexto de evasão tumoral pela ausência do MHC-I. Ao demonstrar a capacidade de células TCD8+ de responder a células tumorais incapazes de apresentar antígenos, os autores apontam novas possibilidades para as imunoterapias disponíveis no mercado.
Figura 1- As células tumorais que constituem o glioma são caracterizadas pela baixa expressão de moléculas do MHC de classe I, mecanismo de evasão do sistema imunológico por ausência do reconhecimento e ativação de células TCD8+. Porém, células fagocíticas, como macrófagos, podem capturar fragmentos de células cancerosas e apresentar de forma cruzada esses antígenos tumorais aos linfócitos TCD8+. Esses linfócitos expressam em sua superfície o receptor NKG2D, que se liga ao NKG2DL, um ligante presente na superfície de células tumorais, causando a morte das mesmas. Assim, apesar da ausência do reconhecimento de antígenos apresentados pelo MHC-I, as células T CD8+ conseguem exercer suas funções citotóxicas pela estimulação da ligação NKG2D-NKG2DL, de forma a conter o tumor.
REFERÊNCIAS
- Andersen, M. H. et al. Cytotoxic T cells. Journal of Investigative Dermatology, v. 126, n. 1, p. 32-41, 2006.
- Butt, N. S. et al. Major Histocompatibility Class-I (MHC-I) downregulation in glioblastoma is a poor prognostic factor but not a predictive indicator for treatment failure. Pathology-Research and Practice, v. 250, p. 154816, 2023.
- Chraa, D. et al. T lymphocyte subsets in cancer immunity: friends or foes. Journal of leukocyte biology, v. 105, n. 2, p. 243-255, 2019.
- Cornel, A. M. et al. MHC class I downregulation in cancer: underlying mechanisms and potential targets for cancer immunotherapy. Cancers, v. 12, n. 7, p. 1760, 2020.
- Hollingsworth, R. E.; Jansen, K.Turning the corner on therapeutic cancer vaccines. npj Vaccines, v. 4, n. 1, p. 7, 2019.
- Kwon, B. S. et al. Immune responses in 4-1BB (CD137)-deficient mice. The Journal of Immunology, v. 168, n. 11, p. 5483-5490, 2002.
- Spranger, S; Gajewsky, T. Mechanisms of tumor cell–intrinsic immune evasion. Annual Review of Cancer Biology, v. 2, p. 213-228, 2018.
- Weller, M. et al. Nature reviews Disease primers, v. 1, n. 1, p. 1-18, 2015

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)