Autores: Jonatan Carvalho e Maísa Leandro
Editora: Profa Dra Vanessa Carregaro Pereira
Seminário apresentado na disciplina Tópicos Avançados de Imunologia do Programa de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
No início de agosto de 2025, Manuel M. Gómez de las Heras e colaboradores publicaram na revista Science Immunology o estudo “CD4 T cell therapy counteracts inflammaging and senescence by preserving gut barrier integrity”, no qual investigaram como a disfunção de células T, causada pela perda da integridade mitocondrial, pode afetar a microbiota e comprometer a barreira intestinal, além de examinar as consequências disso para o envelhecimento1.
O envelhecimento é um processo biológico complexo, associado tanto à redução das respostas imunoprotetoras quanto ao estabelecimento de um estado inflamatório crônico de baixa intensidade, denominado inflammaging. Esse fenômeno tem sido relacionado à disbiose e à disfunção da barreira epitelial, embora os mecanismos que levam a isso sejam pouco compreendidos2. As células T, que sofrem diversas alterações fenotípicas e funcionais durante o envelhecimento, parecem atuar como importantes moduladoras do inflammaging. Apesar de evidências sugerirem o seu envolvimento na perda da dinâmica hospedeiro–microbiota e na disfunção da barreira intestinal, seu papel nesse processo ainda não está totalmente estabelecido3.
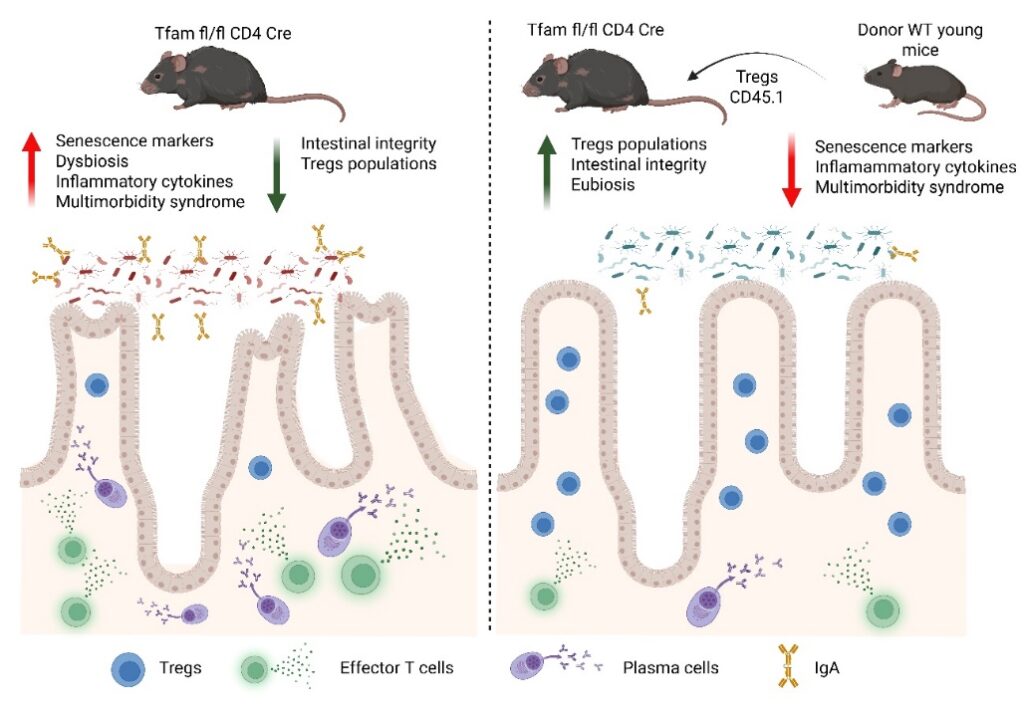
Para tentar elucidar essa questão, os autores utilizaram camundongos com deleção condicional do fator de transcrição mitocondrial A (TFAM), um estabilizador do DNA mitocondrial, em células T (Tfamfl/fl Cd4Cre). Esses camundongos apresentam disfunção mitocondrial em células T, levando ao aparecimento acelerado de características do envelhecimento, síndrome de multimorbidade, inflammaging precoce, aquisição de fenótipos senescentes e redução da sobrevivência4,5. Com o objetivo de investigar a possível correlação desse fenótipo com alterações na microbiota, os autores analisaram os animais no estágio avançado da síndrome de multimorbidade (fase m3). Nessa condição, camundongos Tfamfl/fl Cd4Cre apresentavam alta permeabilidade intestinal, microbiota fecal alterada e translocação bacteriana, detectada no fígado e no soro. O sequenciamento do gene 16S rRNA do conteúdo luminal do íleo terminal e do cólon revelou que os animais Tfamfl/fl Cd4Cre apresentavam disbiose, com expansão de microrganismos associados à inflamação intestinal, como membros da família Enterobacteriaceae.
Para testar se a microbiota contribuía diretamente com o fenótipo, os autores depletaram os microrganismos intestinais dos camundongos Tfamfl/fl Cd4Cre e evidenciaram uma redução na permeabilidade intestinal e translocação bacteriana. Esses resultados foram acompanhados pela redução nos níveis sistêmicos de citocinas inflamatórias, como IFN-γ e TNF, além de um aumento na sobrevida dos animais. Entretanto, ensaios de transplante fecal da microbiota de camundongos Tfamfl/fl Cd4Cre para animais jovens Tfamfl/fl não provocaram alterações nos parâmetros avaliados. Com isso, os autores concluíram que, isoladamente, a disbiose nos animais Tfamfl/fl Cd4Cre não é suficiente para causar inflamação e lesão tecidual em camundongos controle que possuem um sistema imunológico competente.
Considerando que células TCD4+ desempenham papel central na manutenção da simbiose hospedeiro–microbiota, os autores utilizaram citometria de fluxo espectral para caracterizar os linfócitos em placas de Peyer (PPs) e lâminas próprias do cólon (cLPs) de camundongos Tfamfl/fl Cd4Cre. As análises demonstraram uma redução nas populações de células TCD4+ naïve e Tregs, enquanto houve aumento em células TCD4+ de memória efetora (EM) e células TCD4+citotóxicas. Ademais, foi evidenciado uma redução na população de células T reguladoras foliculares (TFR), que se associou ao aumento de plasmócitos produtores de IgA e bactérias fecais IgA+. Esses dados indicam que a disfunção mitocondrial direciona as células T para perfis inflamatórios, com perda de subconjuntos reguladores e foliculares, comprometendo a homeostase da IgA intestinal em camundongos Tfamfl/fl Cd4Cre.
Devido a remodelação considerável dos compartimentos de células T no intestino, os autores avaliaram se a reconstituição de Tregs poderia restaurar a homeostase intestinal e prevenir a síndrome de multimorbidade. A transferência adotiva de Tregs de camundongos jovens CD45.1+ para camundongos receptores CD45.2+ Tfamfl/fl Cd4Cre reequilibrou as respostas de IgA contra bactérias intestinais, preveniu a perda de peso aguda associada à síndrome, reduziu o inflammaging e restaurou a integridade intestinal.
Em conjunto, esses resultados indicam que a disfunção das células T decorrente da deleção de TFAM não apenas induz uma resposta inflamatória exacerbada, como também reduz a simbiose hospedeiro-microbiota. Ademais, esses resultados fornecem insights sobre o potencial de terapias baseadas em células T para retardar patologias associadas ao envelhecimento, uma vez que a transferência de Tregs atenua o envelhecimento sistêmico, aumenta a resiliência a múltiplos sinais de multimorbidade e reforça a integridade da barreira intestinal.
Fig 1: À esquerda, a deleção de TFAM em células T CD4 (Tfamfl/fl Cd4Cre) causa disbiose, aumento de citocinas inflamatórias e de marcadores de senescência, redução de Tregs e perda da integridade intestinal, culminando na síndrome de multimorbidade. À direita, a transferência adotiva de Tregs de camundongos jovens restaura a eubiose, preserva a barreira intestinal e as populações regulatórias, reduzindo inflamação e senescência, e prevenindo a multimorbidade.
Referências
- Gómez de Las Heras MM, Carrasco E, Pérez-Manrique M, et al. CD4 T cell therapy counteracts inflammaging and senescence by preserving gut barrier integrity. Sci Immunol. 2025;10(110):eadv0985. doi:10.1126/sciimmunol.adv0985
- Nguyen, T.Q.T., Cho, K.A. Targeting immunosenescence and inflammaging: advancing longevity research. Exp Mol Med(2025). https://doi.org/10.1038/s12276-025-01527-9
- Carrasco, E., Gómez de las Heras, M.M., Gabandé-Rodríguez, E. et al.The role of T cells in age-related diseases. Nat Rev Immunol 22, 97–111 (2022). https://doi.org/10.1038/s41577-021-00557-4
- Baixauli, F., Acín-Pérez, R., Villarroya-Beltrí, C. et al. Mitochondrial respiration controls lysosomal function during inflammatory T cell responses. Cell Metab 22, 485–498 (2015). https://doi.org/10.1016/j.cmet.2015.07.020
- Gabriela Desdín-Micó et al., T cells with dysfunctional mitochondria induce multimorbidity and premature senescence. Science 368,1371-1376(2020). DOI:10.1126/science.aax086



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)