Autores: Isabela Maria de Mello e Juliana Cristina Costa Madeira
Editado por: Isabel Kinney de Miranda Santos
Referência: Chang Cui, Kasturi Chakraborty, Xu Anna Tang, Guolin Zhou, Kelly Q. Schoenfelt, Kristen M. Becker, Alexandria Hoffman, Ya-Fang Chang, Ariane Blank, Catherine A. Reardon, Hilary A. Kenny, Tomas Vaisar, Ernst Lengyel, Geoffrey Greene and Lev Becker.
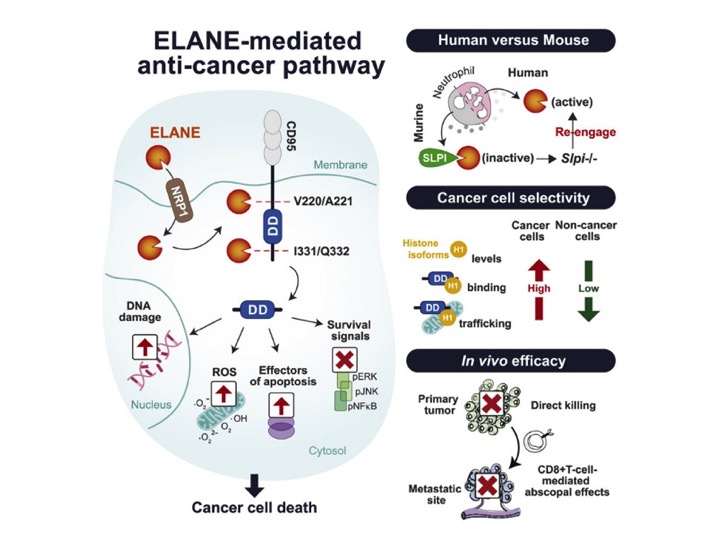
O câncer é um dos principais empecilhos para a longevidade e qualidade de vida das pessoas, uma vez que está entre as principais causas de morte da população mundial1. A dificuldade em encontrar terapias efetivas está na sua heterogeneidade celular e na agressividade dos tratamentos para as células saudáveis1,2. Da mesma forma que a imunidade inata evolui para eliminar com eficácia patógenos que possuem grande diversidade genética3, cabe perguntar: ela seria capaz de também matar células cancerosas? Como diversos estudos registrados na literatura científica demonstram que neutrófilos possuem mecanismos pro e antitumorais4, Cui e colegas resolveram investigar um dos seus componentes celulares, a elastase, a fim de compreender os mecanismos por trás de sua função antitumoral e então explorar possíveis alvos terapêuticos para o câncer.
Os pesquisadores começaram investigando se haviam componentes nos neutrófilos capazes de induzir apoptose em 35 tipos distintos de células tumorais humanas ou murinas. Para isso, foram tratadas com meio condicionado de neutrófilos humanos, o qual foi capaz de induzir morte celular. A elastase (ELANE, da sigla em inglês neutrophil elastase) foi identificada como sendo o componente responsável por mediar o efeito anticâncer em células humanas, mas não em células murinas. Mas, de onde vem a capacidade da elastase de matar apenas as células cancerosas? Na sequência, a investigação dos autores mostrou que, ao ser reconhecida por seu receptor NRP1 e então endocitada, a ELANE clivava enzimaticamente a região c-terminal do CD95, liberando o domínio de morte DD (do inglês Death Domain). Uma vez livre no citosol, o DD interagia com isoformas de histonas H1, que eram translocadas do núcleo para o citosol, induzindo a morte das células tumorais. As histonas H1 são diferencialmente expressas em células tumorais e não tumorais, o que explicaria a seletividade maior da ELANE sobre células tumorais. E por que o mesmo não ocorre com células murinas? Uma explicação seria a presença de inibidores de serino proteases, caso da ELANE, no meio condicionado de neutrófilos murinos. Por meio de abordagens proteômicas Cui e colegas investigaram se havia inibidores de serino proteases no meio condicionado de neutrófilos murinos; com efeito, detectaram a chamada Secretory Leukocyte Peptidase Inhibitor (SLPI). Na ausência de SLPI, a elastase murina (mELANE) se mostrou capaz de matar células tumorais de forma similar à observada para huELANE.
Diante de tais dados, Cui e colegas administraram ELANE diretamente em um tumor e o observaram. Além de reduzir seu tamanho, a ELANE também induziu imunidade adaptativa, caracterizada pelo aumento de linfócitos T CD8+ ativados. Diante desse achado, os pesquisadores investigaram se ocorreu o efeito abscopal, que nada mais é do que o tratamento em um tumor primário provocar a diminuição de um segundo tumor distante. Assim, a ELANE diminuiu o número e o peso de tumores distantes nos diversos modelos estudados, sugerindo que as células tumorais mortas liberavam antígenos que eram reconhecidos por T CD8+ que então migravam para tumores metastáticos.
Por fim, foi avaliada a eficácia do tratamento com ELANE, o qual apresentou eficácia menor in vivo quando comparada à eficácia in vitro, podendo ser explicada pela ação de inibidores de serinoproteases no microambiente tumoral. Diante disso, Cui e colegas testaram a elastase pancreática do porco por ser mais resistente à clivagem e inativação por inibidores. Ela foi capaz de induzir a morte de células tumorais de forma seletiva como a ELANE, apresentando, porém, melhor eficácia terapêutica que a ELANE. Ainda que as terapias anticâncer estejam cada vez mais específicas para cada tipo de tumor, a identificação de um fator capaz de atuar em tumores geneticamente diversos pode, no futuro, ter grande utilidade terapêutica.
Referências:
- Stratton, M.R., Campbell, P.J., and Futreal, P.A. (2009). The cancer genome. Nature, 458, 719–724.
- Vogelstein, B., Papadopoulos, N., Velculescu, V.E., Zhou, S., Diaz, L.A., Jr., and Kinzler, K.W. (2013). Cancer genome landscapes. Science, 339, 1546–1558.
- Yan, J., Kloecker, G., Fleming, C., Bousamra, M., 2nd, Hansen, R., Hu, X., Ding, C., Cai, Y., Xiang, D., Donninger, H., et al. (2014). Human polymorphonuclear neutrophils specifically recognize and kill cancerous cells. OncoImmunology 3, e950163.
- Sagiv, J.Y., Michaeli, J., Assi, S., Mishalian, I., Kisos, H., Levy, L., Damti, P., Lumbroso, D., Polyansky, L., Sionov, R.V., et al. (2015). Phenotypic diversity and plasticity in circulating neutrophil subpopulations in cancer. Cell 10, 562–573.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










