Autores: Ana Carolina Monteleone Cassiano e Vinícius Bottura Apolloni
Editado por Fausto Almeida
Referência: Barkaway, A., Rolas, L., Joulia, R., Bodkin, J., Lenn, T., Owen-Woods, C., & Nourshargh, S. (2021). Age-related changes in the local milieu of inflamed tissues cause aberrant neutrophil trafficking and subsequent remote organ damage. Immunity.
A inflamação constitui um processo importante no envelhecimento. Neste trabalho, os autores buscaram explicar a razão pela qual tecidos envelhecidos não conseguem conter a inflamação e como consequência causar danos em órgãos remotos.
Foi relatado que em tecidos inflamados envelhecidos, os neutrófilos realizavam migração transendotelial reversa (rTEM), que leva à lesão de órgãos remotos. Os autores acreditavam que a inflamação associada ao envelhecimento perturba a dinâmica das células imunológicas. Para isso foi analisado o tráfego de neutrófilos in vivo por microscopia multifotônica intravital (IVM) de alta resolução. Nos camundongos idosos houve alta frequência de rTEM de neutrófilos dentro das junções das células endoteliais (EC). Os neutrófilos iniciavam a diapedese para o tecido inflamado e em seguida retornavam para o lúmen venular. Sabendo que danos em órgãos distantes após uma inflamação local fazem parte de um grande problema em idosos, a detecção de rTEM de neutrófilos aumentada em tecidos envelhecidos podem retratar uma situação até então desconhecida em patologias associadas ao envelhecimento.
O ambiente altamente inflamatório do tecido foi o fator preponderante para a indução de rTEM dos neutrófilos nas vênulas envelhecidas e a quimiocina CXCL1 se destacou por estar aumentada nesse tráfego reverso. Os mastócitos foram detectados como a fonte principal de CXCL1 em tecidos envelhecidos estimulados e como consequência, seu acúmulo nas regiões de junção de EC, se tornando um condutor de rTEM de neutrófilos. A fim de compreender o motivo do excesso de CXCL1 nas junções das EC de vênulas envelhecidas, foi avaliado se o receptor ACKR1 estava relacionado com esse acúmulo. Em experimentos com modelo murino foi comprovada que a retenção de CXCL1 era totalmente mediada por ACKR1, que se encontrava altamente expresso em vênulas pós-capilares envelhecidas. Além disso, a regulação negativa do receptor cognato de CXCL1, o CXCR2, em neutrófilos também contribuiu para o processo de transmigração reversa. Portanto pode-se descrever os componentes essenciais para essa migração desregulada dos neutrófilos: i) aumento em número e estado de ativação de mastócitos, que consequentemente aumentam os níveis de CXCL1 nos tecidos e ii) aumento da proteína de ACKR1 nas junções das EC.
Quanto à capacidade prejudicial da rTEM dos neutrófilos em órgãos remotos, foi comprovado que quando os tecidos envelhecidos sofrem uma lesão de isquemia de reperfusão no músculo cremaster, os neutrófilos que realizaram rTEM ficaram retidos nos pulmões e exibiam um fenótipo com níveis elevados de elastase e CXCR4 na superfície celular. Detalhes de como tais neutrófilos induzem danos aos tecidos ainda precisam ser mais estudados. Os autores ainda propuseram o uso de um anticorpo para bloquear CXCL1, e demonstraram que isso diminuia o dano vascular pulmonar. Os resultados apresentados pelos pesquisadores mostraram que a compreensão do papel dos neutrófilos em tecidos envelhecidos pode contribuir para identificar novos alvos terapêuticos com a finalidade de normalizar o tráfego local de neutrófilos e prevenir danos a órgãos remotos na população idosa.
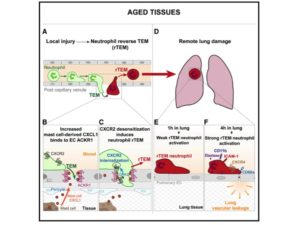
Imagem retirada do artigo referência.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










