Autores: Christian Alves e Maísa Leandro
Editora: Vânia Luiza Deperon Bonato
Seminário apresentado na disciplina Tópicos Avançados de Imunologia do Programa de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP
Em um estudo publicado na Immunity em março de 2025, intitulado "Bile acid receptor FXR promotes intestinal epithelial ferroptosis and subsequent ILC3 dysfunction in neonatal necrotizing enterocolitis", Yuxin Zhang e colaboradores revelaram um novo papel do receptor de ácidos biliares FXR no epitélio intestinal durante a enterocolite necrosante neonatal. Os autores mostraram que a ativação do FXR induz a morte de células epiteliais por ferroptose, causando a liberação de peróxidos lipídicos, que reduzem a produção de IL-22 por células linfoides inatas do tipo 3 (ILC3).
A enterocolite necrosante neonatal (NEC) é uma doença inflamatória intestinal caracterizada por hiperinflamação, isquemia e necrose tecidual, acometendo predominantemente recém-nascidos prematuros e de baixo peso. Nos casos mais graves, a mortalidade pode atingir 80%, sendo necessária intervenção cirúrgica para remoção do tecido necrótico. Fatores como hiperativação da sinalização via receptor Toll-Like 4 (TLR4), imunidade de mucosa imatura e disbiose intestinal estão envolvidos na patogênese da NEC.
A morte de células epiteliais intestinais é uma característica central da NEC que resulta em rompimento da barreira intestinal, permitindo a translocação bacteriana para a circulação. A ferroptose, uma forma de morte celular programada dependente de ferro, promove a geração de espécies reativas de oxigênio e a peroxidação lipídica, sendo associada à patogênese da doença. Além disso, o aumento de níveis de ácidos biliares correlaciona-se com a gravidade e incidência da NEC, acompanhado pela elevação da expressão do receptor nuclear farnesoide X (FXR) no íleo de pacientes afetados pela doença.
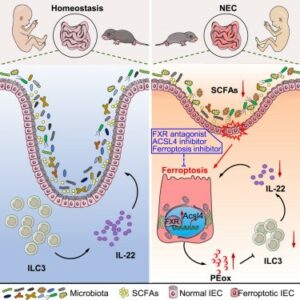
O FXR é um receptor nuclear ativado por ácidos biliares, essencial para a regulação do metabolismo e da homeostase intestinal. Em humanos, a ativação do FXR no intestino induz a secreção do FGF19 na circulação. O estudo mostrou que as concentrações circulantes de FGF19 em recém-nascidos eram inversamente proporcionais ao peso ao nascer e à idade gestacional, sugerindo associação com a prematuridade. Em pacientes com NEC, há um aumento da expressão de FXR e FGF19 nas células epiteliais intestinais. Como esses pacientes apresentam alterações na microbiota, incluindo a redução de bactérias gram-positivas produtoras de ácidos graxos de cadeia curta (SCFAs), os autores investigaram a microbiota usando modelo murino de NEC. A prole de camundongos submetida ao transplante fecal advindo de neonatos humanos com NEC apresentou aumento da expressão de FXR, e esse efeito foi revertido pela administração de butirato, indicando que a expressão de FXR no epitélio intestinal é regulada pelos SCFAs da microbiota.
Para investigar os mecanismos de atuação do FXR no epitélio intestinal durante a doença, os autores desenvolveram um modelo de camundongo com deleção específica de FXR em células epiteliais intestinais. Os animais FXR KO foram protegidos da NEC, apresentando maior sobrevida, menor inflamação e menor permeabilidade intestinal. Análises de scRNA-seq revelaram aumento na expressão de genes relacionados à ferroptose nas células epiteliais dos animais WT, mas não nos FXR KO, indicando que esse processo depende do FXR. O tratamento de filhotes FXR KO com um indutor de ferroptose confirmou essa dependência. Além disso, foi demonstrado que a ferroptose requer ACSL4, uma enzima essencial na peroxidação lipídica. Conjuntamente, os achados revelam que FXR liga-se ao promotor de Acsl4, promovendo sua expressão e aumentando a peroxidação de lipídeos, que são liberados no processo de morte por ferroptose das células epiteliais intestinais durante a NEC.
Para compreender as consequências da ferroptose das células epiteliais intestinais e sua relação com a manutenção da barreira intestinal, os autores mostraram que os animais com NEC apresentaram redução na produção de IL-22, citocina fundamental para a integridade epitelial, fenômeno que não foi observado nos camundongos KO para FXR. Também encontraram diminuição na população de ILC3, principais produtoras de IL-22 no intestino, um efeito ausente nos animais KO. Aprofundando a investigação, os autores descobriram que células epiteliais submetidas à ferroptose liberam peróxidos lipídicos, que comprometem a viabilidade e função das células ILC3. Esse efeito prejudica a produção de IL-22 e, consequentemente, enfraquece a imunidade de mucosa e exacerba a disfunção da barreira intestinal durante a NEC.
Esses achados destacam o papel do FXR na indução de morte de células epiteliais por ferroptose durante a NEC, um processo que compromete a manutenção da barreira epitelial por afetar negativamente tanto a viabilidade das ILC3 como a produção de IL-22 por tais leucócitos inatos. Esse estudo fornece novos insights sobre o potencial terapêutico de modular o FXR e a ferroptose como estratégias para o tratamento da NEC.
Fig. 1: Em condições de homeostase, a microbiota intestinal mantém níveis adequados de SCFAs, que modulam negativamente a expressão de FXR nas células epiteliais intestinais, preservando a integridade da barreira e sustentando a função das ILC3 produtoras de IL-22. Durante a NEC, ocorre desequilíbrio na microbiota e redução na produção de SCFAs, resultando em uma ativação exacerbada de FXR no epitélio. Esse processo induz a expressão de ACSL4, uma enzima chave na peroxidação lipídica, levando ao aumento da ferroptose epitelial e à liberação de peróxidos lipídicos (PEox). Esses metabólitos impactam negativamente a sobrevivência e função das ILC3, reduzindo a produção de IL-22 e comprometendo a homeostase intestinal, contribuindo para a progressão da NEC.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)