Autoras: Amanda Becerra e Rhanoica Oliveira Guerra
Editora: Daniela Carlos Sartori
O estresse agudo é uma resposta natural do corpo frente a situações desafiadoras, mas quando se torna crônico ou intenso, pode contribuir para o surgimento de transtornos mentais como ansiedade e depressão. Nas últimas décadas, a ciência tem mostrado que o sistema imunológico não apenas reage as infecções, mas também participa ativamente da forma como o corpo lida com o estresse. Um dos fenômenos observados nessa interação é o aumento da permeabilidade intestinal conhecido como “Leaky gut ou intestino permeável” que permite a passagem de substâncias do intestino para a corrente sanguínea, ativando o sistema imune. Esse tipo de ativação, embora frequentemente associado a efeitos negativos, pode ter também um papel adaptativo. Ou seja, o corpo tenta se proteger e manter o equilíbrio diante do estresse. Nesse estudo, os pesquisadores tiveram como objetivo avaliar se a ativação precoce do sistema imunológico, especialmente mediada pela molécula IL-22, influencia a resposta ao estresse e o comportamento ansioso em modelos animais.
Os autores investigaram como o estresse ativa o sistema imunológico, utilizando camundongos submetidos ao estresse por contenção — um modelo amplamente utilizado. Um único episódio de 30 minutos aumentou hormônios do estresse e defecação, sem alterar a permeabilidade intestinal. No entanto, a repetição diária do estresse por três dias levou ao aumento da permeabilidade intestinal, evidenciado pelo extravazamento de albumina nas fezes e pela translocação de bactérias e produtos microbianos para a corrente sanguínea. Esses resultados demonstram que episódios leves, mas repetidos, de estresse comprometem a integridade da barreira intestinal, promovendo o chamado "extravazamento intestinal" e ativam o sistema imune.
Após o estresse, observou-se um aumento significativo nos níveis de interleucina-22 (IL-22) no sangue e no intestino dos animais. Esse aumento também ocorreu em outro modelo, o estresse por privação de água (WAS), sugerindo que a produção de IL-22 não é exclusiva ao estresse por contenção.
A hipótese de que o aumento de IL-22 seria secundário à exposição a antígenos microbianos foi apoiada pela redução de sua expressão após a depleção da microbiota intestinal com antibióticos de amplo espectro. A principal fonte celular da IL-22 induzida pelo estresse foi identificada como as células Th17. Notavelmente, o plasma de camundongos estressados foi suficiente para induzir a diferenciação de células T CD4 naïve em células Th17 in vitro, indicando que fatores solúveis presentes no plasma em resposta ao estresse atuam como indutores naturais da polarização Th17.
A análise transcriptômica do intestino revelou a expressão aumentada de genes relacionados a algumas vias imunológicas. Dentre os fatores pró-diferenciação Th17 avaliados, a interleucina-1β (IL-1β) foi significativamente aumentada no sangue e no tecido intestinal dos animais estressados. A importância funcional da IL-1β foi demonstrada pelo uso do antagonista de seu receptor (IL-1RA), que bloqueou, de forma dose-dependente, a diferenciação Th17 in vitro induzida pelo plasma dos camundongos estressados. Esses dados indicam que a IL-1β é um mediador chave da resposta Th17 induzida pelo estresse.
Para avaliar o papel funcional da IL-22 na adaptação ao estresse, os autores utilizaram camundongos knockout para Il22 (Il22⁻/⁻) e heterozigotos (Il22⁺/⁻), submetendo-os ao estresse de contenção e avaliando o comportamento ansioso nos testes de campo aberto (OFT) e labirinto em cruz elevado (EPM). Após o estresse, os camundongos Il22⁻/⁻ apresentaram aumento significativo de comportamento ansioso em comparação aos controles, indicando que a IL-22 é necessária para a resiliência comportamental ao estresse.
Adicionalmente, camundongos Tcrb⁻/⁻ (deficientes em células T αβ), que apresentam níveis elevados de IL-22 devido ao aumento compensatório de ILC3s, mostraram menor comportamento ansioso após o estresse. Isso reforça o papel da IL-22, no controle da ansiedade independentemente de sua origem celular.
Foi observado que a IL-22 apresenta efeito ansiolítico ao modular a atividade dos neurônios no núcleo septal medial e no complexo septal lateral. Em camundongos Tcrb⁻/⁻, a ativação neuronal nessas regiões, normalmente induzida pelo estresse, foi reduzida. O estresse comprometeu seletivamente a barreira hematoencefálica (BHE) no septo, permitindo a entrada de IL-22 periférica. A IL-22 então sinalizou diretamente em neurônios septais via receptores IL-22RA1/IL-10RB, ativando a via JAK-STAT3. Essa sinalização reduziu a excitabilidade neuronal e aumentou a inibição tônica, suprimindo a atividade elétrica desses neurônios.
De forma interessante, em humanos, foi observada uma redução significativa dos níveis plasmáticos de IL-22 em pacientes com transtorno depressivo maior (TDM) em comparação com indivíduos saudáveis. A diminuição foi mais pronunciada em pacientes com depressão moderada a grave e ainda mais evidente naqueles com ansiedade comórbida. Esses achados reforçam a hipótese de que a IL-22 atua como um fator protetor contra os efeitos do estresse crônico, contribuindo para a regulação do humor e possivelmente desempenhando um papel relevante na fisiopatologia de transtornos psiquiátricos.
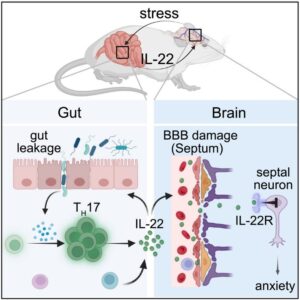 Figura 1: Representação esquemática do eixo intestino-cérebro mediado por IL-22 durante o estresse. O estresse psicológico induz aumento da permeabilidade intestinal (gut leakage), promovendo a ativação de células Th17 e o aumento sistêmico de IL-22. Essa citocina alcança o cérebro, atravessa a barreira hematoencefálica (BBB) na região septal e atua sobre neurônios que expressam IL-22R, suprimindo sua ativação e atenuando comportamentos ansiosos induzidos pelo estresse.
Figura 1: Representação esquemática do eixo intestino-cérebro mediado por IL-22 durante o estresse. O estresse psicológico induz aumento da permeabilidade intestinal (gut leakage), promovendo a ativação de células Th17 e o aumento sistêmico de IL-22. Essa citocina alcança o cérebro, atravessa a barreira hematoencefálica (BBB) na região septal e atua sobre neurônios que expressam IL-22R, suprimindo sua ativação e atenuando comportamentos ansiosos induzidos pelo estresse.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










