Por: Danilo Machado e Jefferson Antônio Leite (doutorandos IBA/FMRP-USP)
Editora: Luciana Benevides
A autofagia é um processo crucial para a homeostase celular, e ocorre quando componentes celulares como proteínas, lipídios, açúcares e organelas são direcionados à degradação. O processo de autofagia consiste basicamente do sequestro de moléculas com a formação do autofagossomo, fusão do autofagossomo com lisossomo, formando o autolisossomo, permitindo assim a degradação dos materiais captados (1). Dentre os diversos componentes deste processo pode-se citar o LC3 (microtubule-associated protein light-chain 3). LC3R é recrutada para dupla membrana de autofagossomos, permitindo o alongamento e fechamento de sua membrana (2).
LC3 também pode ser recrutada para outras membranas, incluindo-se membranas simples de autofagossomos em um processo denominado LAP. LAP vem do inglês LC3-associated phagocytosis. Neste processo de fagocitose ocorre o recrutamento de alguns componentes da autofagia (3). A via é ativada a partir do reconhecimento de patógenos e células apoptóticas por determinados receptores de membrana (TLR1/2, TLR2/6, TLR4, TIM4 and FcR), com subsequente formação de vesículas de membrana simples. Dessa forma, LAP existe na interseção das duas vias conservadas, a de autofagia e fagocitose, em que o crosstalk entre a fagocitose e o processamento acaba por moldar a resposta imune (4). O que diferencia estes dois processos são formas de ativação e complexos. Diferente da autofagia canônica, LAP não requer alguns componentes da autofagia canônica, como ULK1, FIP200, ATG13 para iniciação do complexo, porém, utiliza Beclin-1 (BECN1) e VPS34 que contem Rubicon (RUBCN) (2; 4).
De maneira interessante, Cunha et al., (2018) (5) demonstraram em um estudo recente publicado no periódico Cell que o clearance de células tumorais apoptóticas por células mieloides leva a ativação de LAP, direcionando o perfil de diferenciação e polarização das mesmas, para macrófagos M2, observada através da alta expressão do marcador CD206. Tais eventos, contribuem para a inibição da resposta imune antitumoral, o que favorece o crescimento do tumor e a formação de metástases. Não obstante, a inoculação de células tumorais em animais condicionalmente deficientes em células mieloides para várias moléculas que participam da formação de LAP (Rubicon, VPS34, Atg5, Atg7) levou a uma redução no crescimento tumoral e a formação de metástases, de forma que, esta proteção estava associada a polarização de macrófagos associados ao tumor para um perfil pro-inflamatório (M1). Por meio de uma análise de sequenciamento do RNA de macrófagos isolados do tumor de camundongos selvagens e deficientes para LAP, foi observado que a deficiência desta molécula, levou a uma regulação positiva de genes associados a resposta de interferon do tipo I (IFN-I), mediado pela ativação do sensor de DNA STING. Adicionalmente, o aumento da produção de IFN-β na ausência de LAP, levou a uma maior infiltração de linfócitos CD8+ produtores de IFN-γ e granzima B, que através de sua função citotóxica contribuíram para o controle do crescimento tumoral e da formação de metástase (Figura 1).
Em suma, a formação do complexo LAP após o clearance de células tumorais apoptóticas por macrófagos presentes no microambiente tumoral, direciona a polarização dos mesmos para um perfil anti-inflamatório (M2) inibindo a produção de IFN-I e consequente ativação e resposta de linfócitos T CD8, o que culmina em um maior crescimento tumoral. O estudo abre perspectivas para o desenvolvimento de novas terapias baseadas na inibição da formação do complexo LAP, o que poderia vir a contribuir para o controle do crescimento tumoral.
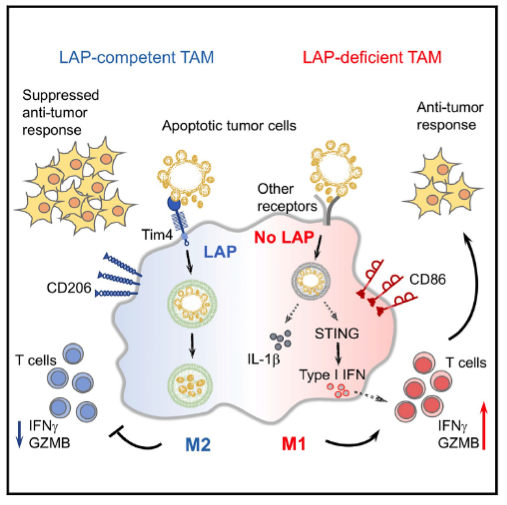
Figura 1. Geração do LAP (LC3 associated phagocytosis) ocorre quando células tumorais em apoptose são fagocitadas por macrófagos no microambiente tumoral. Macrófagos associados ao tumor (TAMs) deficientes para LAP possuem características pró-inflamatórias (M1) produzindo elevados niveis de IFNβ através da ativação de STING, promovendo uma resposta anti tumoral mediada por linfócitos T CD8.
Referências
- KIMMELMAN, A. C; WHITE, E. Autophagy and Tumor Metabolism. Cell Metab. v. 02; 25(5), p. 1037–1043, 2017.
- WHITE, E; MEHNERT, J, M; CHAN, C. S. Autophagy, Metabolism, and Cancer. Clin Cancer Res. v. 15; 21(22), p. 5037–5046, 2015.
- ROMAO,S; Münz, C. SLC3-associated phagocytosis. Autophagy. v. 10:3, p. 526-528, 2014.
- SCHILLE, S. et al. LC3-associated phagocytosis in microbial pathogenesis. International Journal of Medical Microbiology. v. 308, p. 228–236, 2018.
- CUNHA, L.D. et al. LC3-Associated Phagocytosis in Myeloid Cells Promotes Tumor Immune Tolerance. Cell. 2018 Oct 4;175(2):429-441

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










