Autores: Cícero José Luíz dos Ramos Almeida e Júlia Teixeira de Castro
Editado por Beatriz Ferreira
Yan Y, Ramanan D, Rozenberg M, McGovern K, Rastelli D, Vijaykumar B, Yaghi O, Voisin T, Mosaheb M, Chiu I, Itzkovitz S, Rao M, Mathis D, Benoist C. Interleukin-6 produced by enteric neurons regulates the number and phenotype of microbe-responsive regulatory T cells in the gut. Immunity. 2021 Mar 9;54(3):499-513.e5. doi: 10.1016/j.immuni.2021.02.002. PMID: 33691135.
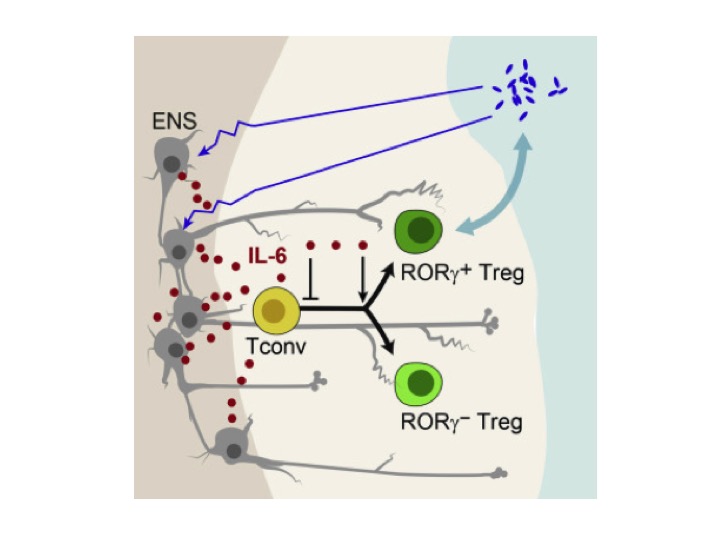
O intestino é um dos principais locais de ativação da resposta imune devido à exposição diária a antígenos alimentares e provenientes de patógenos (1). Além disso, esse órgão contribui para a manutenção da homeostase regulando a ativação e diferenciação de células imunológicas, como as células T reguladoras (Tregs) (2). Inclusive, as Tregs são as principais células que contribuem para a tolerância imunológica intestinal, apresentando diferentes fenótipos responsivos, de acordo com a exposição a microrganismos comensais no colón (Tregs RORy+), ou ao estresse tecidual (Tregs Helios+) (3-5). Por outro lado, em resposta aos sinais extrínsecos, o sistema nervoso entérico mantém uma comunicação íntima com o sistema imune pela liberação de moléculas neuromoduladoras para prevenir distúrbios na homeostase intestinal, como por exemplo perturbações que causam alterações na microbiota (6). Entretanto, o funcionamento do eixo de regulação entre a microbiota, o sistema imune e sistema nervoso entérico ainda é pouco elucidado. Procurando entender melhor como funciona esse eixo, Yan e colaboradores (7) elucidaram uma função surpreendente dos neurônios entéricos, os quais inibem a diferenciação de células Tregs Foxp3+ via liberação de IL-6.
Nesse trabalho, através de técnicas de microscopia, os autores observaram que as células Tregs se comunicavam com as projeções das fibras nervosas presentes na lâmina própria das glândulas intestinais, e esse contato era independente da expressão de RORC ou do tipo de neurônio motor presente. Porém, as Tregs não apenas mantinham interações com as fibras nervosas. Os autores observaram em co-culturas e modelo transwell, que os neurônios entéricos eram capazes de inibir a diferenciação de células Tregs in vitro, sendo esta inibição independente do contato célula-célula. Em seguida, através de técnicas imunocelulares e moleculares, encontraram que a IL-6 liberada pelos neurônios era o mediador que estava inibindo a diferenciação de células Tregs in vitro. Essa inibição ocorria principalmente pela diminuição do repertório total de células Tregs Foxp3+ e aumento da fração de células Tregs Foxp3+RORg+. Posteriormente, esses resultados foram validados, utilizando neurônios de animais knockout de IL-6 e células T CD4+ naive de animais knockout para o IL-6r ou STAT3.
Ainda, para avaliar os efeitos da microbiota nessas células, os autores infectaram camundongos germfree com patógenos que sabidamente induziam Tregs RORg+ (8), e observaram diversas mudanças transcricionais em genes ligados a expressão de neuromoduladores liberados por neurônios entéricos. Destes, os neuropeptídios CGRP e VIP mostraram-se essenciais para a liberação de IL-6 e assim inibiam a diferenciação de células Tregs, desvendando o eixo de comunicação entre a microbiota, Tregs e células neuronais entéricas (Figura 1). Com esse trabalho, foi possível evidenciar a importância dos neurônios como reguladores-chave na manutenção da homeostase e tolerância periférica, limitando uma resposta descontrolada das células Tregs e elucidando um complexo mecanismo de imunorregulação intestinal.
Referências do Artigo:
1 Okumura R, Takeda K. Maintenance of intestinal homeostasis by mucosal barriers. Inflamm Regen. 2018;38:5. Published 2018 Apr 2. doi:10.1186/s41232-018-0063-z
2 Harrison OJ, Powrie FM. Regulatory T cells and immune tolerance in the intestine [published correction appears in Cold Spring Harb Perspect Biol. 2013 Aug;5(8):a021022]. Cold Spring Harb Perspect Biol. 2013;5(7):a018341. Published 2013 Jul 1. doi:10.1101/cshperspect.a018341
3 J.D. Wheaton, C.H. Yeh, M. Ciofani Cutting Edge: c-Maf Is Required for Regulatory T Cells To Adopt RORγt+ and Follicular Phenotypes J. Immunol., 199 (2017), pp. 3931-3936
4 E.A. Wohlfert, J.R. Grainger, N. Bouladoux, J.E. Konkel, G. Oldenhove, C.H. Ribeiro, J.A. Hall, R. Yagi, S. Naik, R. Bhairavabhotla, et al. GATA3 controls Foxp3+ regulatory T cell fate during inflammation in mice J. Clin. Invest., 121 (2011), pp. 4503-4515
5 Luu M, Steinhoff U, Visekruna A. Functional heterogeneity of gut-resident regulatory T cells. Clin Transl Immunology. 2017;6(9):e156. Published 2017 Sep 22. doi:10.1038/cti.2017.39
6 N.J. Yang, I.M. Chiu Bacterial signaling to the nervous system through toxins and metabolites J. Mol. Biol., 429 (2017), pp. 587-605
7 Yan Y, Ramanan D, Rozenberg M, McGovern K, Rastelli D, Vijaykumar B, Yaghi O, Voisin T, Mosaheb M, Chiu I, Itzkovitz S, Rao M, Mathis D, Benoist C. Interleukin-6 produced by enteric neurons regulates the number and phenotype of microbe-responsive regulatory T cells in the gut. Immunity. 2021 Mar 9;54(3):499-513.e5. doi: 10.1016/j.immuni.2021.02.002. PMID: 33691135.
8 N. Yissachar, Y. Zhou, L. Ung, N.Y. Lai, J.F. Mohan, A. Ehrlicher, D.A. Weitz, D.L. Kasper, I.M. Chiu, D. Mathis, C. Benoist An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk Cell, 168 (2017), pp. 1135-1148.e12

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










