Autores: Bruna Manuella Souza Silva e Rafael de Souza Pontes
Editor: Ademilson Panunto Castelo
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada USP/RP
O estudo intitulado “STING licensing of type I dendritic cells potentiates antitumor immunity”, publicado na revista Science Immunology, em fevereiro de 2024, por Wang e cols., buscou identificar o papel dos subconjuntos de células do sistema imunológico na imunidade antitumoral mediada por STING.1
As células animais e de plantas apresentam sistemas de detecção de DNAs, os quais constituem padrões moleculares associados a patógenos (PAMPs) ou a lesões (DAMPs). Em vertebrados, um desses sistemas dependem da ativação de uma proteína de sinalização associada ao retículo endoplasmático conhecida como “estimulador de genes de interferons” ou simplesmente STING (do inglês stimulator of interferon genes). STING desempenha um papel importante na regulação da expressão de genes de interferons do tipo I e outras citocinas inflamatórias, montando uma resposta imunológica inata robusta contra infecções e cânceres.2 STING é ativada pelo dinucleotídeo GMP-AMP cíclico (cGAMP), o qual é formado pela ação da enzima “sintetase de cGAMP” (cGAS, do inglês cGAMP synthetase) a partir dos substratos GTP e ATP.3,4 De fato, esse mensageiro secundário endógeno, o cGAMP, é produzido quando cGAS se liga a DNAs microbianos (PAMPs) ou do próprio organismo (DAMPs) como um sinal de perigo.5 Em células cancerosas, a instabilidade genômica gerada por danos ao DNA que não é adequadamente reparado pode desencadear a detecção desse DNA e a sinalização por cGAS-STING, um mecanismo chave de ativação imunológica contra tumores.6 Posto isto, podemos vislumbrar o uso de agonistas de cGAS-STING como um potencial tratamento contra cânceres.
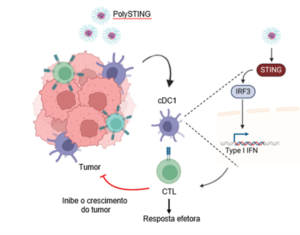
Neste estudo, foi utilizada como agonista uma nanopartícula polimérica ativadora de STING (polySTING), que é composta por cGAMP encapsulado em polímeros ultrassensíveis ao pH à base de policarbonato (PSC7A). Quando administrada experimentalmente dentro de tumores que foram induzidos em camundongos, a nanopartícula foi capaz de agir no microambiente e diminuir a massa tumoral. Foi analisado quais subconjuntos de células do sistema imunológico seriam respondedores a polySTING e indutores de imunidade antitumoral em resposta à essa nanopartícula. PolySTING apresentou certa preferência por células mieloides, tais como macrófagos e células dendríticas (DCs), tanto no microambiente tumoral quanto nos órgãos linfoides drenantes. Vale salientar que polySTING produziu um mecanismo de ativação dupla (shock-and-lock approach), onde o agonista de STING atua em poucas horas (shock) enquanto o polímero sintético induz uma expressão prolongada de interferons (IFN) do tipo I. Os investigadores evidenciaram que a nanopartícula é rapidamente degradada, o que diminui o surgimento dos efeitos colaterais.
Em ensaios adicionais, o estudo mostrou que dentre os subconjuntos de células mieloides, a ausência de DCs nos animais diminuía significativamente a efetividade de polySTING. Dentre os tipos de células dendríticas, demonstrou-se que as convencionais do tipo 1 (cDC1s) se mostraram essenciais para o controle da progressão do tumor. Essas conclusões foram decorrentes de investigação em camundongos destituídos de cDC1 (Batf3-/-) ou deficientes de STING apenas nessas cDC1 (XCR1CreSTINGfl/fl), os quais não foram capazes de controlar o crescimento do tumor ao se administrar polySTING. Além disso, quando camundongos desprovidos de cDC1 (Batf3-/-) foram reconstituídos com cDC1s de animais controles (selvagens), esses passaram a ter uma resposta antitumoral induzida por polySTING. Contrastando com esse resultado, se os animais recebessem cDC1s deficientes em STING ou do fator 3 regulador de interferon (IRF3) e fossem tratados com polySTING, não controlavam o crescimento do tumor. Além de mostrar a importância de cDC1 para terapia intratumoral com polySTING, esses resultados revelaram que o mecanismo é dependente de IRF3. Ademais, os autores determinaram que a forma pela qual polySTING induzia controle do crescimento do tumor através de cDC1s dependia da indução de respostas de células T citotóxicas no microambiente tumoral.
Em pacientes com câncer, a presença de células cDC1s associadas ao controle tumoral se correlaciona com a maior sobrevida e resposta a terapia antitumoral desses pacientes. Esses achados associados aos resultados em modelo experimental permitem inferir que a expressão dos marcadores de resposta efetora, CXCL9, de ativação, XCR1, e STING, pode ser preditivo para a terapia de determinadas doenças oncológicas.
Bibliografia
1 - WANG, J. et al. STING licensing of type I dendritic cells potentiates antitumor immunity. Science Immunology, v. 9, n. 92, p. eadj3945, 2024.
2 - LI, T.; CHEN, Z. J. The cGAS–cGAMP–STING pathway connects DNA damage to inflammation, senescence, and cancer. Journal of Experimental Medicine, v. 215, n. 5, p. 1287-1299, 2018.
3 - BARBER, G. N. STING: infection, inflammation and cancer. Nature Reviews Immunology, v. 15, n. 12, p. 760-770, 2015.
4 - ISHIKAWA, H.; BARBER, G. N. STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling. Nature, v. 455, n. 7213, p. 674-678, 2008.
5 - SUN, L. et al. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway. Science, v. 339, n. 6121, p. 786-791, 2013.
6- SCHREIBER, R. D.; OLD, L. J.; SMYTH, M. J. Cancer immunoediting: integrating immunity’s roles in cancer suppression and promotion. Science, v. 331, n. 6024, p. 1565-1570, 2011.

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)