Os conteúdos publicados no SBlogI são autorais e de responsabilidade dos(as) autores(as)
Descrição: Este texto tem como base a Tese de Doutorado de Valéria de Lima Kaminski, cuja defesa foi realizada no dia 20 de Janeiro de 2020, junto ao Programa de Pós-Graduação em Genética e Biologia Molecular (PPGBM) da Universidade Federal do Rio Grande do Sul (UFRGS), com trabalho desenvolvido no Laboratório de Imunobiologia e Imunogenética da mesma instituição. Atualmente, Valéria é pesquisadora em nível de pós-doutorado junto ao Laboratório de Imunologia Aplicada, vinculada ao Programa de Pós-Graduação em Biotecnologia do Instituto de Ciência e Tecnologia (ICT) da Universidade Federal de São Paulo (UNIFESP) – campus de São José dos Campos/SP.
Por: Valéria de Lima Kaminski, Ph. D.
O presente texto tem como objetivo explicar como o sistema imune de uma gestante pode influenciar no risco para desenvolvimento do Transtorno do Espectro Autista (TEA) em seus filho(a)s. Mais especificamente, pretende-se responder o seguinte questionamento: de que forma problemas durante a gestação podem contribuir para o risco de TEA? Tal resposta exige que revisitemos alguns aspectos imunológicos tanto da gravidez quanto do TEA, mas, como ilustra a Figura 1, a ligação entre gestação e TEA está intimamente relaciona à ‘faca de dois gumes’ do sistema imune: a inflamação.
A gestação humana é um processo complexo que envolve diferentes sistemas fisiológicos tanto da mãe quanto do feto, os quais sofrem influência direta do sistema imune materno (1). Tamanha complexidade se deve ao fato de o feto ser comparável a um enxerto semi-alogênico para o sistema imunológico da mãe, visto que 50% dos antígenos expressos pelo feto/placenta são de origem paterna. Dadas as características invasivas e imunossopressoras da placenta, a mesma pode, ainda, ser comparável a um tumor. Dessa maneira, durante todo o período gestacional, há uma intensa e minuciosa regulação imunológica. Células e vesículas extracelulares da própria placenta são as grandes responsáveis por essa fina regulação imune que, em última instância, leva à tolerância ao feto em desenvolvimento e, consequentemente, a uma gestação de sucesso (1).
O Transtorno do Espectro Autista (TEA) é uma condição que impacta o neurodesenvolvimento fetal (2). Antes de 2013, vários distúrbios da família do autismo eram diagnosticados separadamente. Após a publicação da quinta edição do Manual de Diagnóstico e Estatística de Transtornos Mentais (DSM-5), esses diferentes diagnósticos – como a Síndrome de Asperger, a Síndrome de Rett e o 'transtorno invasivo do desenvolvimento sem outra especificação' (PDD-NOS), passaram a ser tratados conjuntamente como TEA. Não se sabe quais as causas exatas do TEA, apesar de já ter sido descoberto que essa condição possui um forte componente genético (3) e que distúrbios imunológicos são um componente do quadro clínico do transtorno (4). Algumas complicações gestacionais são sugeridas como fatores ambientais de risco para TEA (2), principalmente àquelas com background inflamatório. Assim, diferentes aspectos imunológicos e ambientais durante a gravidez podem ser fatores-chave para o desenvolvimento de distúrbios gestacionais e/ou para a incidência de problemas neurológicos na prole.
Imunogenética é a área do conhecimento que trata da base genética das respostas imunes. Ela inclui o estudo das vias imunológicas consideradas “normais” e o estudo de variações genéticas que resultam em respostas imunes defectivas ou ineficientes. Além de serem importantes per se, os estudos no ramo da imunogenética têm um grande potencial para a descoberta de novos alvos terapêuticos para diversas doenças relacionadas ao sistema imunológico (5). Em razão disso, diversos estudos têm investigado a potencial influência de variantes em genes relacionados ao sistema imune no risco para desenvolvimento de desordens gestacionais e, também, no contexto do TEA.
Para entender como a inflamação impacta a gestação, precisamos estudar doenças relacionadas a desbalanços no sistema imune materno. Complicações gestacionais e seus possíveis gatilhos ambientais podem se dar no contexto de desequilíbrios nos níveis de moléculas responsáveis pela comunicação das células do sistema imune – as citocinas (6,7); como, também, serem resultado de um determinado background genético da mãe ou do próprio feto/placenta. Por exemplo, níveis aumentados da citocina chamada interleucina-17 (IL-17) são observados em gestações sem intercorrências em comparação com casos de aborto espontâneo idiopático (6–8). Diferentes moléculas, além de citocinas, também participam da regulação imunológica durante a gravidez (1). A molécula HLA-G possui grande impacto na gestação, atuando na promoção da imunotolerância da mãe em relação ao feto; em outras palavras, HLA-G evita a ocorrência de respostas inflamatórias exacerbadas na interface materno-fetal. Variantes no gene HLA-G têm sido alvo de investigação no contexto de intercorrências gestacionais, incluindo casos de aborto (9). Nesse contexto, foi proposta uma prova de conceito de um método contraceptivo baseado na diminuição da expressão de HLA-G, por meio do uso de micro-RNAs que tem como alvo o RNA mensageiro desse gene. A contracepção seria efetivada com base no fato de que HLA-G participa tanto da manutenção da tolerância ao longo do período gestacional quanto da vasculogênese e angiogênese que garante a fixação do embrião na decídua. A ausência de níveis adequados de HLA-G, via regulação negativa mediada pelos micro-RNAs no ambiente uterino, impediria o estabelecimento da gestação (10).
Além das células e moléculas do sistema imune, vesículas extracelulares (EVs – do inglês extracellular vesicles) são extremamente abundantes na interface materno-fetal sendo de fundamental importância nos processos imunológicos da gestação (1). EVs são secretadas por todas as células eucariontes já estudadas e também por organismos procariontes (1). Dentre essas vesículas, na gestação, destacam-se os exossomos, que são nanovesículas formadas por uma bicamada lipídica. Exossomos em geral possuem a capacidade de transportar diferentes moléculas tanto em seu interior quanto nas suas próprias membranas, constituindo um importante mecanismo de comunicação celular à longa distância (11). A placenta ativamente produz e secreta exossomos, o que leva à formação de uma “nuvem” dessas nanovesículas ao redor da interface materno-fetal (12). Na interface materno-fetal, os exossomos contribuem para a promoção de um ambiente imunossupressor, controlando respostas imunes maternas que podem ser nocivas ao feto/placenta (13,14). Exossomos derivados da placenta podem ser detectados na circulação periférica de gestantes, onde aumentam em número ao longo do período gestacional (15). Em casos de pré-eclâmpsia (PE), por exemplo, o número dessas nanovesículas é muito maior em comparação ao encontrado em uma gestação normotensa, sendo a avaliação do perfil de exossomos uma potencial estratégia para monitorar o risco de intercorrências gestacionais (16–18).
A PE é uma doença exclusiva da gestação. Com caráter multifatorial, a PE acomete de 2 a 8% de todas as mulheres gestantes e tem como principais diagnósticos a presença de hipertensão de novo e proteinúria após a vigésima semana da gestação (7). Sendo uma doença complexa – influenciada por vários genes, variantes em diferentes genes vêm sendo investigadas no contexto da PE; a variante CCR5Δ32, por exemplo, já foi associada à proteção contra desenvolvimento de PE (8,19,20). O gene CCR5 codifica um receptor de quimiocinas – que são citocinas quimiotáticas, importante em respostas inflamatórias, pois atraem as células do sistema imune aos sítios de inflamação. Foi proposto que tal papel protetor de CCR5Δ32 se dá em razão de a deleção de 32 pares de bases na região codificante do gene CCR5 levar à produção de uma proteína com características alteradas, que não é expressa na superfície das células. Sua ausência na superfície de leucócitos leva, em última instância, à diminuição da resposta inflamatória mediada por CCR5. Inflamação crônica é parte importante da patogênese da PE; assim, a presença dessa variante potencialmente contribui como um fator imunogenético de proteção contra essa doença gestacional (8).
Independente do que ocorre na gestação, é importante destacar que aspectos imunogenéticos são importantes alvos de estudo no TEA, como variantes genéticas relacionadas ao MHC/HLA (21,22), variantes com impacto pró-inflamatório (23,24) e, ainda, variantes em genes relacionados ao imunometabolismo (25,26). A contribuição de fatores do sistema imunológico, mais especificamente a inflamação, pode ser estudada tanto como causa quanto como consequência de TEA. Com relação às causas, recorre-se à investigação de insultos que levam à inflamação durante a gestação. No tocante às consequências, os estudos abordam a presença de inflamação nos diferentes sintomas que afetam indivíduos com TEA, como epilepsia (Kaminski et al., 2020 – dados em preparação para publicação).
Com relação aos gatilhos inflamatórios gestacionais que já foram indicados como fatores de risco para o TEA, destacam-se as consequências da chamada ativação imune materna, amplamente referida na literatura científica como “MIA” – do inglês maternal immune activation. MIA refere-se, basicamente, às respostas pró-inflamatórias do sistema imune materno e suas consequências para feto em desenvolvimento (2). Dado o componente inflamatório da MIA, tanto sua incidência quanto sua amplitude também podem ser influenciadas por componentes imunogenéticos maternos (8,9).
Após revisar os aspectos mencionados nos 7 parágrafos acima, podemos traçar os caminhos para responder nosso questionamento inicial, dissertando sobre os problemas da gestação que já foram associados ou sugeridos como fatores de risco para o desenvolvimento de TEA na prole. Como ponto de partida, relembremos que episódios de MIA já foram indicados como fatores de risco para TEA (2). Durante a gravidez, diferentes insultos podem ser causas ou consequências de MIA nas gestações de mães de crianças com TEA. Dentre eles, destacam-se infecções (27,28), febre (29), desbalanço no nível de citocinas (30), presença de anticorpos maternos contra proteínas encefálicas do feto (31,32), hipertensão (33), diabetes (34), obesidade e sobrepeso (35) gestacionais, bem como a PE (36).
Somado a todos os fatores acima, há, ainda, o potencial papel de EVs como agentes mecanísticos da MIA no contexto de susceptibilidade ao TEA. Em outras palavras, hipotetiza-se que fatores inflamatórios, carreados por exossomos, atuem nas respostas pró-inflamatórias que levam à MIA e eventualmente atingem o sistema nervoso central do feto (Kaminski et al., 2020 – dados em preparação para publicação). Essa hipótese fundamenta-se na observação de um número elevado de exossomos na circulação sanguínea de crianças diagnosticadas com TEA em comparação ao encontrado em crianças de desenvolvimento típico (37). Além disso, diferentes EVs podem contribuir para o desencadeamento da MIA, dados, por exemplo, o papel imunorregulador de exossomos durante a gestação (1); o componente inflamatório (2,5) e a desregulação na quantidade de EVs em casos tanto de PE (15,16) quanto de diabetes gestacional (38), bem como o fato de essas doenças já terem sido indicadas como fatores de risco para o TEA (33–36). Além disso, exossomos possuem a capacidade de estimular a micróglia (39), sendo, portanto, potenciais veículos para moléculas pró-inflamatórias que eventualmente possam atingir o encéfalo do feto em desenvolvimento (40), contribuindo para o risco de desenvolvimento do Transtorno do Espectro Autista, no contexto de uma intercorrência gestacional com fundo inflamatório.
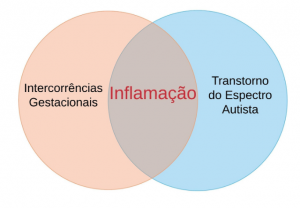
Figura 1. A inflamação como como fator imunológico comum no quadro clínico de intercorrências gestacionais e da sintomatologia do Transtorno do Espectro Autista (TEA) também pode ser considerada um fator gestacional de risco para desenvolvimento do TEA.
Referências
- Kaminski VL, Ellwanger JH, Chies JAB (2019) Extracellular vesicles in hostpathogen interactions and immune regulation — exosomes as emerging actors in the immunological theater of pregnancy. Heliyon 5, e02355. doi: 10.1016/j.heliyon.2019.e02355
- Meltzer A & Van de Water J (2017) The Role of the Immune System in Autism Spectrum Disorder. Neuropsychopharmacology 42(1):284-298. https://doi.org/10.1038/npp.2016.158
- Bai D, Yip BHK, Windham GC, Sourander A, Francis R, Yoffe R, Glasson E, Mahjani B, Suominen A, Leonard H, Gissler M, Buxbaum JD, Wong K, Schendel D, Kodesh A, Breshnahan M, Levine SZ, Parner ET, Hansen SN, Hultman C, Reichenberg A, Sandin S (2019) Association of Genetic and Environmental Factors With Autism in a 5-Country Cohort. JAMA Psychiatry. doi: 10.1001/jamapsychiatry.2019.1411
- Masi A, Glozier N, Dale R, Guastella AJ (2017) The immune system, cytokines, and biomarkers in autism spectrum disorder. Neurosci. Bull. 33 (2):194-204. doi: 10.1007/s12264-017-0103-8
- Nature. Immunogenetics. (2019) Disponível em: https://www.nature.com/subjects/immunogenetics. Acesso em: 31 de outubro de 2019.
- Kaminski VL, Ellwanger JH, Matte MCC, Savaris RF, Vianna P, Chies JAB (2018) IL17 blood levels increase in healthy pregnancy but not in spontaneous abortion. Mol. Biol. Rep. 45 (5), 15651568. doi: 10.1007/s1103301842687
- Michita RT, Kaminski VL, Chies JAB (2018) Genetic Variants in Preeclampsia: Lessons From Studies in Latin-American Populations. Front. Physiol. 9:1771. doi: 10.3389/fphys.2018.01771
- Kaminski VL, Ellwanger JH, Sandrim V, Pontillo A, Chies JAB (2019) Influence of NKG2C gene deletion and CCR5Δ32 in PreeclampsiaApproaching the effect of innate immune gene variants in pregnancy. Int J Immunogenet. 46(2):8287. doi: 10.1111/iji.12416
- Michita RT, Zambra FMB, Fraga LR, Sanseverino MTV, Callegari-Jacques SM, Vianna P, Chies JAB (2016) A tug-of-war between tolerance and rejection - New evidence for 3'UTR HLA-G haplotypes influence in recurrent pregnancy loss. Hum. Immunol. 77 (10), 892-897. doi: 10.1016/j.humimm.2016.07.004
- Kaminski V, Ellwanger JH, Chies JAB (2017) Down-regulation of HLA-G gene expression as an immunogenetic contraceptive therapy. Med Hypotheses. 102:146-149. doi: 10.1016/j.mehy.2017.03.030
- Théry C, Zitvogel L, Amigorena S (2002) Exosomes: composition, biogenesis and function. Nat. Rev. Immunol. 2 (8), 569-79. doi: 10.1038/nri855
- Mincheva-Nilsson L, Baranov V (2010) The role of placental exosomes in reproduction. Am. J. Reprod. Immunol. 63 (6), 520-33. doi: 10.1111/j.1600-0897.2010.00822.x
- Hedlund M, Stenqvist AC, Nagaeva O, Kjellberg L, Wulff M, Baranov V, Mincheva-Nilsson L (2009) Human placenta expresses and secretes NKG2D ligands via exosomes that down-modulate the cognate receptor expression: evidence for immunosuppressive function. J. Immunol. 183 (1), 340-51. doi: 10.4049/jimmunol.0803477
- Stenqvist AC, Nagaeva O, Baranov V, Mincheva-Nilsson L (2013) Exosomes secreted by human placenta carry functional Fas ligand and TRAIL molecules and convey apoptosis in activated immune cells, suggesting exosome-mediated immune privilege of the fetus. J. Immunol. 191 (11), 5515-23. doi: 10.4049/jimmunol.1301885
- Salomon C, Torres MJ, Kobayashi M, Scholz-Romero K, Sobrevia L, Dobierzewska A, Illanes SE, Mitchell MD, Rice GE (2014) A gestational profile of placental exosomes in maternal plasma and their effects on endothelial cell migration. PLoS One. 9 (6), e98667. doi: 10.1371/journal.pone.0098667
- Kshirsagar SK, Alam SM, Jasti S, Hodes H, Nauser T, Gilliam M, Billstrand C, Hunt JS, Petroff MG (2012) Immunomodulatory molecules are released from the first trimester and term placenta via exosomes. Placenta. 33 (12), 982-90. doi: 10.1016/j.placenta.2012.10.005
- Tannetta D, Collett G, Vatish M, Redman C, Sargent IL (2017) Syncytiotrophoblast extracellular vesicles - Circulating biopsies reflecting placental health. Placenta. 52, 134-8. doi: 10.1016/j.placenta.2016.11.008
- Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I (2017) Update of syncytiotrophoblast derived extracellular vesicles in normal pregnancy and preeclampsia. J. Reprod. Immunol. 119, 98-106. doi: 10.1016/j.jri.2016.08.008
- Gurdol F, Yurdum LM, Ozturk U, Isbilen E, Cakmakoglu B (2012) Association of the CC chemokine receptor 5 (CCR5) polymorphisms with preeclampsia in Turkish women. Arch. Gynecol. Obstet. 286, 51-54. https://doi.org/10.1007/s00404-012-2244-3
- Telini B, Veit TD, Chies JAB, Vianna P (2014) The CCR5Δ32 polymorphism as a pre-eclampsia susceptibility marker: an evaluation in Brazilian women. Arch. Gynecol. Obstet. 290, 1-3. https://doi.org/10.1007/s00404-014-3246-0
- Mostafa GA, Shehab AA, Al-Ayadhi LY (2013) The link between some alleles on human leukocyte antigen system and autism in children. J Neuroimmunol 255(1-2):70-74. https://doi.org/10.1016/j.jneuroim.2012.10.002
- Guerini FR, Bolognesi E, Chiappedi M, Ripamonti E, Ghezzo A, Zanette M, Sotgiu S, Mensi MM, Carta A, Canevini MP, Zanzottera M, Agliardi C, Costa AS, Balottin U, Clerici M (2017) HLA-G coding region polymorphism is skewed in autistic spectrum disorders. Brain Behav Immun 67:308-313. https://doi.org/10.1016/j.bbi.2017.09.007
- Heuer L, Braunschweig D, Ashwood P, Van de Water J, Campbell DB (2011) Association of a MET genetic variant with autism-associated maternal autoantibodies to fetal brain proteins and cytokine expression. Transl Psychiatry 1:e48. https://doi.org/10.1038/tp.2011.48
- Safari MR, Ghafouri-Fard S, Noroozi R, Sayad A, Omrani MD, Komaki A, Eftekharian MM, Taheri M (2017) FOXP3 gene variations and susceptibility to autism: A case-control study. Gene 596:119-122. https://doi.org/10.1016/j.gene.2016.10.019
- Cieslinska A, Kostyra E, Chwala B, Moszynska-Dumara M, Fiedorowicz E, Teodorowicz M, Savelkoul HFJ (2017) Vitamin D Receptor Gene Polymorphisms Associated with Childhood Autism. Brain Sci 7(9). https://doi.org/10.3390/brainsci7090115
- Mobasheri L, Moossavi SZ, Esmaeili A, Mohammadoo-Khorasani M, Sarab GA (2019) Association between vitamin D receptor gene FokI and TaqI variants with autism spectrum disorder predisposition in Iranian population. Gene 144133. https://doi.org/10.1016/j.gene.2019.144133
- Chess S, 1977. Follow-up report on autism in congenital rubella. J. Autism Child. Schizophr. 7, 69-81.
- Nielsen-Saines K, Brasil P, Kerin T, Vasconcelos Z, Gabaglia CR, Damasceno L, Pone M, Abreu de Carvalho LM, Pone SM, Zin AA, Tsui I, Salles TRS, da Cunha DC, Costa RP, Malacarne J, Reis AB, Hasue RH, Aizawa CYP, Genovesi FF, Einspieler C, Marschik PB, Pereira JP, Gaw SL, Adachi K, Cherry JD, Xu Z, Cheng G, Moreira ME, (2019) Delayed childhood neurodevelopment and neurosensory alterations in the second year of life in a prospective cohort of ZIKV-exposed children. Nat. Med. 25, 1213-1217. doi: 10.1038/s41591-019-0496-1
- Hornig M, Bresnahan MA, Che X, Schultz AF, Ukaigwe JE, Eddy ML, Hirtz D, Gunnes N, Lie KK, Magnus P, Mjaaland S, Reichborn-Kjennerud T, Schjølberg S, Øyen AS, Levin B, Susser ES, Stoltenberg C, Lipkin WI (2018) Prenatal fever and autism risk. Mol. Psychiatry. 23, 759-766. doi: 10.1038/mp.2017.119
- Smith SE, Li J, Garbett K, Mirnics K, Patterson PH (2007) Maternal immune activation alters fetal brain development through interleukin-6. J. Neurosci. 27, 10695-702
- Braunschweig D, Ashwood P, Krakowiak P, Hertz-Picciotto I, Hansen R, Croen LA, Pessah IN, Van de Water J (2008) Autism: maternally derived antibodies specific for fetal brain proteins. Neurotoxicology. 29(2):226-31. doi: 10.1016/j.neuro.2007.10.010
- Braunschweig D, Golub MS, Koenig CM, Qi L, Pessah IN, Van de Water J, Berman RF (2012) Maternal autism-associated IgG antibodies delay development and produce anxiety in a mouse gestational transfer model. J. Neuroimmunol. 252, 56-65. doi: 10.1016/j.jneuroim.2012.08.002
- Curran EA, O'Keeffe GW, Looney AM, Moloney G, Hegarty SV, Murray DM, Kenny LC (2018) Exposure to Hypertensive Disorders of Pregnancy Increases the Risk of Autism Spectrum Disorder in Affected Offspring. Molecular neurobiology, 55(7), 5557–5564. doi:10.1007/s12035-017-0794-x
- Hoirisch-Clapauch S, Nardi AE (2018) Autism spectrum disorders: let's talk about glucose? Transl Psychiatry. 9(1):51. doi: 10.1038/s41398-019-0370-4
- Windham GC, Anderson M, Lyall K, Daniels JL, Kral TVE, Croen LA, Levy SE, Bradley CB, Cordero C, Young L, Schieve LA (2019) Maternal Pre-pregnancy Body Mass Index and Gestational Weight Gain in Relation to Autism Spectrum Disorder and other Developmental Disorders in Offspring. Autism Res. 12(2):316-327. doi: 10.1002/aur.2057
- Maher GM, O'Keeffe GW, Kearney PM, Kenny LC, Dinan TG, Mattsson M, Khashan AS (2018) Association of Hypertensive Disorders of Pregnancy With Risk of Neurodevelopmental Disorders in Offspring: A Systematic Review and Meta-analysis. JAMA Psychiatry. 75, 809-819. doi: 10.1001/jamapsychiatry.2018.0854
- Tsilioni I, Theoharides TC (2018) Extracellular vesicles are increased in the serum of children with autism spectrum disorder, contain mitochondrial DNA, and stimulate human microglia to secrete IL- 1β. J. Neuroinflammation. 15, 239. doi: 10.1186/s12974-018-1275-5
- Salomon C, Scholz-Romero K, Sarker S, Sweeney E, Kobayashi M, Correa P, Longo S, Duncombe G, Mitchell MD, Rice GE, Illanes SE (2012) Gestational Diabetes Mellitus Is Associated With Changes in the Concentration and Bioactivity of Placenta-Derived Exosomes in Maternal Circulation Across Gestation. Diabetes. 65(3):598-609. doi: 10.2337/db15-0966
- Budnik V, Ruiz-Cañada C, Wendler F (2016) Extracellular vesicles round off communication in the nervous system. Nat. Rev. Neurosci. 17, 160-72. doi: 10.1038/nrn.2015.29
- Matsumoto J, Stewart T, Banks WA, Zhang J (2017) The Transport Mechanism of Extracellular Vesicles at the Blood-Brain Barrier. Curr Pharm Des. 23(40):6206-6214. doi: 10.2174/1381612823666170913164738

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










