Por: Luis Eduardo Alves Damasceno e Mariana Soares Pena Ribeiro (doutorandos IBA/FMRP-USP)
Editora: Luciana Benevides
As células dendríticas (DCs) possuem um papel central de ligação entre as respostas imunes inata e adaptativa, como ocorrem nas doenças alérgicas de pele. A ativação de DCs pela exposição aos alérgenos é caracterizada pelo aumento da expressão de complexo de histocompatibilidade de classe II (MHCII) e pela migração dessas células para o linfonodo drenante. Tal migração é dependente de receptores de quimiocinas como o CCR7 (1), que se liga ao CCL21 produzido no endotélio vascular (2).
A resposta adaptativa se inicia no linfonodo, onde as DCs irão apresentar o antígeno às células T, resultando em ativação, diferenciação e expansão clonal desses linfócitos. Sabe-se que as DCs ativadas também expressam outros receptores de quimiocionas, como o CXCR5, que são importantes para a localização das DCs no linfonodo, o que favorece uma respota imune efetora mais robusta (2, 3). A subpopulação de DCs específica da pele CD301b+ induz uma resposta imune do tipo Th2. No entanto, a ativação das células T por esta subpopulação também depende de um processo de migração nos linfonodos, o que não está completamente claro, podendo, inclusive, ser dependente de outos receptores de quimiocionas como CCR8 (4).
Recentemente, Sokol e colaboradores (5) demonstraram em publicação na revista immunity um importante papel do receptor de quimiocina CCR8 para a migração eficiente dessa subpopulação específica de DCs (CD301b+) para o linfonodo após exposição a um alérgeno na pele. De fato, a imunização de animais com OVA associada a papaína foi capaz de gerar um aumento substancial de células CD301b+ nos linfonodos drenantes (dLN), evento essencial para a montagem de uma resposta Th2. Após 24 horas de exposição ao alérgeno detectou-se altos níveis de expressão gênica de Ccl8 nos dLNs, cuja produção estava confinada à região interfolicular e medular do LN. Curiosamente, observou-se que embora o receptor de quimiciona CCR7, classicamente conhecido por permitir a migração de DCs para o LN tenha permitido a migração de DCs CD301b+ da pele para o seio subcapsular (SCS), a deficiência de CCR8 preveniu sua migração pelo parênquima, sugerindo um papel de CCR8 no posicionamento destas células dentro do LN. Por imunofluorescência, foi possível perceber que a expressão de CCL8 no dLN após a imunização co-localizava com macrófagos das regiões interfolicular e medular próximos às DCs CD301b+. Uma análise mais detalhada desse fenômeno revelou que as células responsáveis por essa produção de CCL8 eram macrófagos fenotipicamente caracterizados como CD169+SIGNR1+. Mas como esse eixo promove uma melhor migração e posicionamento dessas DCs no LN. Os pesquisadores descobriram um importante sinergismo entre CCL8 e CCL21, cujas quimiocinas em associação promoveram maior indice de quimiotaxia de células CD301b+ in vitro. A sinalização desencadeada pela CCL8 nestas DCs parece promover aumento da expressão da quinase Src e fosfatase SHP2, cujas moléculas foram descritas por induzirem uma migração mais eficiente via CCL21-CCR7 (2). Por fim, o trabalho demonstra que a ausência de CCR8 especificamente em células CD301b+ compromete a montagem da resposta adaptativa do tipo 2, associada à uma reduzida frequência de células T CD4 produtoras de IL-4 e IL-13 (Figura 1). Portanto, a migração de determinadas subpopulações de DCs via receptores de quimiocinas pode ocorrer de modo contexto-dependente. Desta forma, o estudo revela um novo aspecto de como a imunidade inata pode regular a montagem de uma resposta adaptativa eficiente.
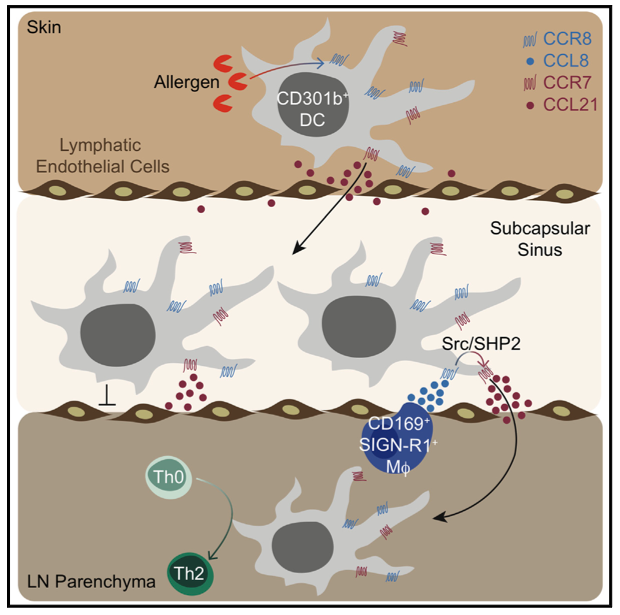
Figura 1. Migração de células dendríticas CD301b+ para oparênquima do linfonodo durante indução de uma resposta adaptativa do tipo 2. A exposição do antígeno na pele leva na ativação de células dendríticas, as quais permanecem com expressão basal de CCR7, mas passam a ter alta expressão de CCR8. Isso permite sua migração pelos vasos linfáticos até o seio subcapsular, onde encontram a quimiocina CCL8 produzida pelos macrófagos CD169+SIGN-R1+. A interação CCL8-CCR8 induz a expressão de Src e SHP2, importantes para promover uma migração eficiente das DCs e por intensificar a sinalização CCL21-CCR7. Logo, as DCs CD301b+ são capazes de migrar pelo parênquima dos linfonodos e induzir uma resposta do Th2 robusta.
Referências
1-Iwasaki, A., and Medzhitov, R. (2015). Control of adaptive immunity by the innate immune system. Nat. Immunol. 16, 343–353.
2-Worbs, T., Hammerschmidt, S.I., and Forster, R. (2017). Dendritic cell migration in health and disease. Nat. Rev. Immunol. 17, 30–48.
3-Léon, B., Ballesteros-Tato, A., Browning, J.L., Dunn, R., Randall, T.D., and Lund, F.E. (2012). Regulation of T(H)2 development by CXCR5+ dendritic cells and lymphotoxin-expressing B cells. Nat. Immunol. 13, 681–690.
4-Kumamoto, Y., Hirai, T., Wong, P.W., Kaplan, D.H., and Iwasaki, A. (2016). CD301b+ dendritic cells suppress T follicular helper cells and antibody responses to protein antigens. eLife 5, https://doi.org/10.7554/eLife.17979.
5-Sokol, C. L., Camire, R. B., Jones, M. C., & Luster, A. D. (2018). The Chemokine Receptor CCR8 Promotes the Migration of Dendritic Cells into the Lymph Node Parenchyma to Initiate the Allergic Immune Response. Immunity, 49(3), 449–462.e7.

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










