Por: Marcílio Jorge Fumagalli e Bruno Marcel (Doutorandos IBA/FMRP/USP)
Editora: Luciana Benevides
A pele é o maior órgão do corpo humano e a primeira linha de defesa do organismo, tendo uma função importante como barreira física, química e imunológica (1). Essa barreira tecidual é constante alvo de diversos agentes estressores (1). Além disso, a pele é colonizada por diversos microorganismos comensais, que auxiliam na manutenção da homeostase, por meio de estímulos à produção de peptídeos antimicrobianos e regeneração tecidual (1). Esses agentes comensais se comunicam com diversas células do sistema imune (2, 3). Devido a diversidade de antígenos expressos pela microbiota comensal, espera-se que exista um número considerável de linfócitos T específicos para esses microorganismos (3). Já foi demonstrado que S. epidermidis induz um aumento de subpopulações de células residentes T CD8+ produtores de IL-17A ou IFN-g e T CD4+ produtores de IL-17A (3). No entanto, nenhum trabalho evidenciou o papel fisiológico dessas células e o seu impacto em processos como manutenção da homeostase ou regeneração tecidual. Entretanto, já foi demonstrado utilizando-se modelo animal de regeneração tecidual que ILCs presentes na pele tem um papel central para a manutenção da homeostase e o reparo tecidual, por meio da produção de IL-5 e IL-13 (4).
Para entender o papel desses subtipos de linfócitos TCD8+ produtores de IL-17A (Tc17) e IFN-g (Tc1) específicos para S. epidermidis, Oliver e colaboradores (5) inicialmente demonstraram um aumento populacional desses subtipos celulares. Além disso, tais células ainda apresentaram um aumento da expressão de marcadores celulares relacionados com memória, tal como CD103 e CD69. Após administração de S. epidermidis associado a diferentes agentes estressores na pele de camundongos WT, demonstrou-se que linfócitos Tc17 passam a produzir IL-5 e IL-13, citocinas classicamente associadas com a resposta do tipo 2. No entanto, em condições de homeostase, sem agentes estressores, essas células não produzem IL-5 ou IL-13, embora análises de perfil transcricional demonstrem que as mesmas estejam comprometidas com o perfil do tipo 2. Em outras palavras, essas células Tc17 comensais específicas já possuem um perfil transcricional associado com o tipo 2, mas precisam de um estímulo adicional para dar início a produção de IL-5 ou IL-13. As células T reguladoras residentes na pele regulam negativamente a produção de IL-5 ou IL-13 por células T comensais específicas. A falha na regulação, faz com que células Tc17 comensais específicas produzam IL-5 ou IL-13 independente da presença de agentes estressores. Além disso, foi demonstrado que IL-18 é um dos gatilhos necessários para que células Tc17 produzam IL-5 ou IL-13, amplificando a inflamação e o dano tecidual. Em modelo animal de reparo tecidual, observou-se que células Tc17, fontes de IL-13, contribuem para a regeneração tecidual auxiliando na manutenção da homeostase (Figura 1). O presente estudo demonstrou que células Tc17 comensais específicas podem desempenhar diferentes funções, dependendo do microambiente e dos estímulos desencadeados.
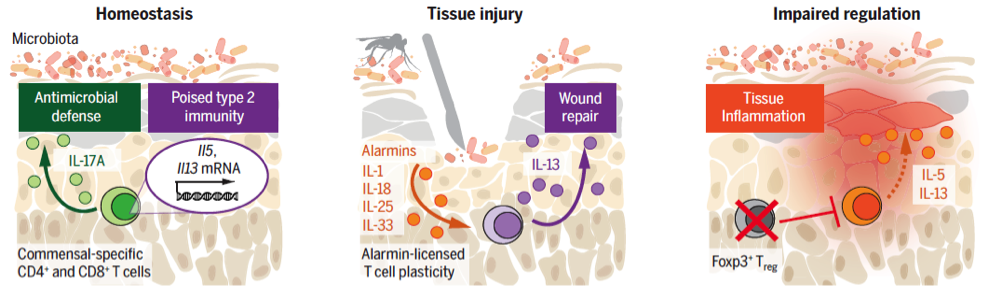
Figura 1. Linfócitos T específicos à microbiota comensal desempenham um papel importante na adaptação ao dano tecidual. Células T efetoras residentes produzem IL-17A em condições homeostáticas que auxilia na produção de peptídeos antimicrobianos, e também possuem um perfil transcricional associado ao tipo 2. Em modelo de reparo epitelial, o dano tecidual induz a secreção de alarminas como a IL-18, que auxilia células Tc17 comensais específicas a produzirem IL-13 e dessa forma auxiliar no reparo tecidual. A falha na regulação negativa por parte das células Treg Foxp3+ promove a liberação de citocinas do tipo 2 por células Tc17 comensais específicas contribuindo para a inflamação tecidual.
Referências:
1 - Byrd AL et. al. The human skin microbiome. Nat Rev Microbiol. 2018 v.16(3): p.143-155.
2 - Eyerich S et al. Cutaneous Barriers and Skin Immunity: Differentiating A Connected Network. Trends Immunol. 2018 v.39(4): p.315-327
3- Naik S et al. Commensal–dendritic-cell interaction specifies a unique protective skin immune signature. Nature, 2015 v. 520(7545) p.104-8.
4- Rak GD et al. IL-33-Dependent Group 2 Innate Lymphoid Cells Promote Cutaneous Wound Healing. J Invest Dermatol. 2016 v.136(2): p.487-496
5- Harrison, Oliver J. et al. Commensal-specific T cell plasticity promotes rapid tissue adaptation to injury. Science, v. 363, n. 6422, p. eaat6280, 2019.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










