Autores: Nayara Pereira e Erasme Gbaguidi
Editora: Profa Daniela Carlos Sartori
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada USP/RP
Referência: Volkov M, Brinkhaus M, van Schie KA, Bondt A, Kissel T, van der Kooi EJ, Bentlage AEH, Koeleman CAM, de Taeye SW, Derksen NI, Dolhain RJEM, Braig-Scherer U, Huizinga TWJ, Wuhrer M, Toes REM, Vidarsson G, van der Woude D. IgG Fab Glycans Hinder hFcRn-Mediated Placental Transport. J Immunol. 2023 Jan 15;210(2):158-167. doi: 10.4049/jimmunol.2200438. PMID: 36480251.
Um estudo inédito publicado na Revista Journal of Immunology em Janeiro de 2023 elucidou detalhes do fenômeno de transferência de anticorpos IgG neutralizantes maternos para os bebês via placenta.
A imunoglobulina G (IgG) representa uma importante classe de anticorpos no corpo, sendo a única imunoglobulina capaz de ser transferida pela placenta durante a gravidez. O estudo publicado por um grupo da Holanda mostra que alterações na glicosilação da molécula de IgG dificulta a transferência placentária dessa imunoglobulina através do receptor Fc neonatal humano (hFcRn).
O hFcRn é um receptor de imunoglobulinas não clássico, com funções não imunológicas que possui alta afinidade por IgG, sendo responsável pela reciclagem dessa imunoglobulina no sangue. A meia vida das imunoglobulinas, como a IgA é de aproximadamente 5 a 7 dias, ao passo que a IgG permanece no sangue por até 21 dias, devido ao processo de reciclagem promovido pelo receptor hFcRn1. O estudo em questão buscou identificar se a glicosilação de IgG na região Fab do anticorpo, não apenas na região Fc como comumente descrito, tinha efeitos no processo de transferência de anticorpos via placenta.
A glicosilação da região Fc dos anticorpos é um processo pós-transcricional que influencia na afinidade dos anticorpos pelos respectivos receptores FcγR2. As diferentes combinações de carboidratos ancorados na imunoglobulina alteram a estrutura da molécula e interferem na interação desta com os receptores, consequentemente impactando na função efetora da célula ativada pelo receptor3. A glicosilação da região Fab é bem menos comum e ocorre com maior frequência em anticorpos autorreativos como os ACPA (anticitrulinated protein antibodies), os quais são marcadores imunológicos da artrite reumatoide4.
Pesquisas anteriores sobre a transferência de anticorpos glicosilados via placenta não levavam em consideração a região especifica da glicolisação, tornando difícil distinguir se haveria algum benefício ou maleficio na presença de glicosilação na região Fab5. Além disso, acreditava-se que a diferença espacial e estrutural entre a região Fab e a região de ligação do hFcRn não causaria alteração na interação hFcRn-IgG. Entretanto, estudos recentes mostraram que a composição e a carga da região Fab pode afetar a meia vida da IgG circulante6, sugerindo que a interação entre a glicoslilação de Fab e a ligação a hFcRn é mais complexa do que se imaginava.
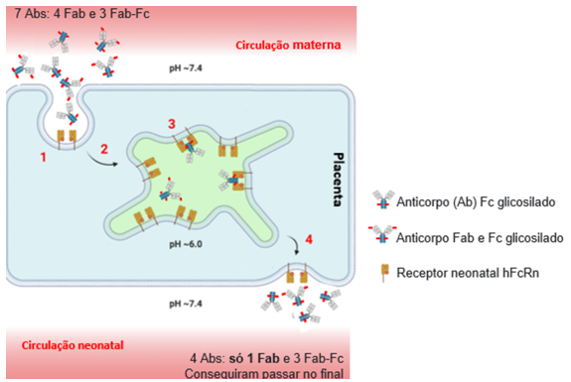
Para explorar essa questão, os autores desenvolveram anticorpos monoclonais recombinantes com diferentes padrões de glicosilação, apenas na região Fc ou na região Fc e Fab. A realização de experimentos analíticos buscou testar a afinidade desses anticorpos com o receptor hFcRn. Nesses experimentos, o Kd da associação anticorpo-receptor não mostrou diferenças entre as diferentes combinações de glicosilação. Da mesma maneira, análises de cromatografia que visavam detectar a retenção do anticorpo ao receptor, não mostram diferenças entre as combinações de glicosilação. Entretanto, quando avaliado a ligação dos anticorpos glicosilados com hFcRn em um experimento de competição in vitro, na presença do receptor ancorado a membrana plasmática, ficou claro que aqueles anticorpos glicosilados na região Fab não eram eficientes em se ligar nos receptores hFcRn quando comparados aos anticorpos glicosilados apenas na região Fc.
Por fim, para validar o estudo em modelo humano de transferência de IgG placentária, anticorpos glicosilados foram dosados no soro de mãe em puerpério e no cordão umbilical de seus bebês. Em mães portadoras de artrite reumatoide, foi detectado que os anticorpos ACPA, ricamente Fab-glicosilados, não eram transferidos efetivamente para o recém-nascidos. De maneira similar outros anticorpos Fab-glicosilados não ACPA também possuem dificuldade em serem transferidos quando comparados a anticorpos glicosilados apenas na região Fc. Em resumo, os resultados sugerem que Fab glicanos dificultam a interação IgG-FcRn e portanto, afetam negativamente a transferência transplacentária de IgG. Esses achados contribuem para estudos futuros sobre a imunidade passiva materno-fetal e apontam para novos alvos terapêuticos relacionados ao hFcRn e a disponibilidade de IgG na circulação.
Figure 1. Glicanos da cadeia leve Fab da IgG impedem o transporte placentário mediado pelo FcRn. Ab: Anticorpos; Fab: porção Fab do anticorpo; Fc : porção Fc do anticorpo. Exemplo descrito na figura: Sete anticorpos estão disponíveis para atravessar a placenta, quatro glicosilados apenas na porção Fab e três nas porções Fab e Fc. Apenas quatro anticorpos conseguem atravessar a barreira sendo que apenas 1 possui glicolisação única na porção Fab.
Referências citadas no texto:
- Ward, E. S., J. Zhou, V. Ghetie, and R. J. Ober. 2003. Evidence to support the cellular mechanism involved in serum IgG homeostasis in humans. Int. Immunol.15: 187-195.
- Dekkers, G., L. Treffers, R. Plomp, A.E. H. Bentlage, M. deBoer,C.A.M.Koeleman, S. N. Lissenberg-Thunnissen, R. Visser, M. Brouwer, J. Y. Mok, et al. 2017. Decodingthe human immunoglobulin G-glycan repertoire reveals a spectrum of Fc-receptor- and complement-mediated-effector activities. Front. Immunol. 8: 877.
- Štambuk T, Klasić M, Zoldoš V, Lauc G. N-glycans as functional effectors of genetic and epigenetic disease risk. Mol Aspects Med. 2021 Jun;79:100891. doi: 10.1016/j.mam.2020.100891. Epub 2020 Aug 27. PMID: 32861467.
- Hafkenscheid, L., A. Bondt, H. U. Scherer, T. W. Huizinga, M. Wuhrer, R. E.Toes, and Y. Rombouts. 2017. Structural analysis of variable domain glycosylation of anti-citrullinated protein antibodies in rheumatoid arthritis reveals the presence of highly sialylated glycans. Mol. Cell. Proteomics 16: 278287.
- Jansen, B., Bondt, A., Reiding, K. et al. MALDI-TOF-MS reveals differential N-linked plasma- and IgG-glycosylation profiles between mothers and their newborns. Sci Rep 6, 34001 (2016). https://doi.org/10.1038/srep34001
- Piche-Nicholas, N. M., L. B. Avery, A. C. King, M. Kavosi, M. Wang, D. M.O’Hara, L. Tchistiakova, and M. Katragadda. 2018. Changes in complementarity-determining regions significantly alter IgG binding to the neonatal Fc receptor (FcRn) and pharmacokinetics. MAbs 10: 81-94.

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)