Autores: Bruna Manuella Souza Silva e Rafael de Souza Pontes
Editado por: Vânia Bonato
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada USP/RP.
O estudo intitulado “Microbial metabolite enhances immunotherapy efficacy by modulating T cell stemness in pan-cancer”, publicado na revista Cell, em março de 2024, por Jia e cols., buscou investigar como a microbiota e seus metabolitos podem melhorar a eficácia da imunoterapia de checkpoint imunológico contra câncer e mostrou que isso ocorre por meio da indução de células T do tipo tronco.
O trato gastrointestinal hospeda leucócitos que se comunicam com a microbiota intestinal, e a microbiota afeta a maturação e ação do sistema imunológico. A microbiota intestinal é um dos fatores que influenciam na eficácia da imunoterapia contra tumores. Evidências recentes mostraram que o transplante de microbiota fecal melhora a responsividade dos bloqueios de checkpoint imune 1,2.
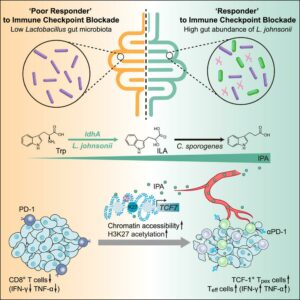
A infiltração de células T no microambiente tumoral desempenha papel fundamental na imunoterapia de checkpoint imunológico 3. Subtipos de células T CD8 têm sido associados com atividade efetora contra tumores. Alguns trabalhos apontaram que o progenitor de células T CD8 exaustas (Tpex) responde à imunoterapia de checkpoint imunológico. As células Tpex exibem características de células-tronco, logo, são capazes de se autorrenovar, proliferar e diferenciar-se em células T CD8 efetoras. Devido à microbiota intestinal influenciar na maturação do sistema imunológico, a hipótese de que a microbiota e/ou seus metabólitos pudessem regular o programa de células T CD8 foi investigada.
Jia e colaboradores 4 inocularam a linhagem celular M38 de adenocarcinoma colorretal em camundongos, seguida pela administração de três doses de imunoterapia com anticorpos monoclonais (mAb) contra PD1. Eles observaram variabilidade nas respostas dos animais ao tratamento, com alguns apresentando aumento no volume tumoral e outros redução, classificando-os em respondedores (R) e respondedores ruins (RR). Posteriormente, os pesquisadores exploraram o efeito da microbiota na variabilidade de resposta à imunoterapia. Para isso, administraram um coquetel de antibióticos para eliminar a microbiota dos camundongos e realizaram transplantes fecais de camundongos respondedores e respondedores ruins. Os camundongos que receberam fezes dos respondedores ruins exibiram resposta reduzida à terapia com mAb contra PD-1 em comparação àqueles que receberam fezes dos respondedores, sugerindo um papel direto da microbiota intestinal na eficácia da terapia de checkpoint imunológico.
Para identificar o componente específico da microbiota responsável pelo efeito na terapia, os pesquisadores sequenciaram as fezes dos animais respondedores e não respondedores. Uma maior abundância de bactérias do gênero Lactobacillus foi observada, especialmente da espécie L. johnsonii, nas fezes dos animais que responderam positivamente ao tratamento. Em seguida, administraram por via oral L. johnsonii ou meio condicionado livre de células, no qual a bactéria foi cultivada, para os camundongos juntamente com a terapia com mAb contra PD-1. Ambos os tratamentos potencializaram a resposta à terapia de checkpoint imunológico, indicando que o efeito antitumoral da L. johnsonii se deve, principalmente, às moléculas secretadas pela bactéria.
Avaliando o plasma dos camundongos R e RR, encontraram maior presença do metabólito ácido indol-3-propiônico (IPA) da via do metabolismo do triptofano nos camundongos respondedores. A administração do metabólito aos camundongos promoveu resposta antitumoral aumentada juntamente com a imunoterapia (mAb contra PD-1), por meio do aumento na infiltração de células T CD8 nos tumores e ativação de células Tpex durante a imunoterapia. O sequenciamento dos transcritos das células T CD8 infiltradas no tumor demonstrou que o IPA proveniente da microbiota tinha a capacidade de modular o programa de células-tronco das células T CD8+ e promover a diferenciação das células Tpex por meio do aumento da acetilação de histonas H3K27.
O triptofano pode ser metabolizado pela microbiota intestinal sequencialmente em ácido indol-3-pirúvico (IPYA), ácido indol-3-láctico (ILA), ácido indol-3-acrílico (IA) e, finalmente, em ácido indol-3-propiônico (IPA). A análise de espectrometria de massas da cultura de L. johnsonii mostrou que a bactéria pode metabolizar o triptofano até ILA, sendo Clostridium sporogenes da microbiota responsável por realizar a etapa subsequente de conversão de ILA em IPA, resultando no aumento da eficácia da imunoterapia.
Em resumo, o artigo mostra que L. johnsonii pode potencializar a eficácia da terapia de checkpoint imunológico ao aumentar a produção de IPA e aprimorar a atividade das células Tpex. Os pesquisadores propõem que o estudo pode levar ao uso tanto de L. johnsonii quanto o IPA como adjuvantes para pacientes submetidos à imunoterapia contra o câncer.
Resumo: A capacidade de resposta do ICB está positivamente ligada à abundância de Lactobacillus johnsonii comensal. A suplementação com L. johnsonii ou com o metabólito derivado do triptofano, o ácido indol-3-propiônico (IPA), aumenta a eficácia da imunoterapia com mAb contra PD-1 mediada por células T CD8. L. johnsonii colabora com o Clostridium sporogenes para produzir o IPA. O IPA modula o programa das células T CD8 e facilita a geração de células T CD8 progenitoras exaustas (Tpex) ao aumentar a acetilação de H3K27.
Bibliografia
- Owaga, E. et al. Células Th17 como potenciais alvos terapêuticos probióticos em doenças inflamatórias intestinais. Int. J. Mol. 16, 20841–20858 (2015).
- Paijens, S.T., Vledder, A., de Bruyn, M., and Nijman, H.W. (2021). Tumorinfiltrating lymphocytes in the immunotherapy era. Cell. Mol. Immunol. 18, 842–859.
- Iida, N., Dzutsev, A., Stewart, C.A., Smith, L., Bouladoux, N., Weingarten, R.A., Molina, D.A., Salcedo, R., Back, T., Cramer, S., et al. (2013). Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment. Science 342, 967–970.
- Jia, D., et al. (2024). Microbial metabolite enhances immunotherapy efficacy by modulating T cell stemness in pan-cancer. Cell, 187(7), 1651-1665.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)