Por: Eduardo Damasceno e Camila Oliveira Silva Souza (doutorandos IBA-FMRP/USP)
Editora: Luciana Benevides
O câncer de fígado é uma das principais causas de mortes por câncer em todo mundo. Os tratamentos de câncer bem como o próprio desenvolvimento do câncer são influenciados pela desregulação da microbiota [1]. O principal elo para a translocação bacteriana entre o fígado e o intestino é a circulação entero-hepática da bile, metabólico derivado do colesterol. A síntese deste metabólico ocorre em 2 etapas, síntese primária no fígado e síntese secundária no intestino. O colesterol sintetizado no fígado dará origem a ácidos biliares primários que circulam até o intestino, onde novamente são sintetizados por intermédio dos componentes microbianos dando origem a ácidos biliares secundários que tem como função auxiliar na motilidade e secreção dos produtos ingeridos pela dieta [2]. Neste contexto, Ma, et al. [3] avaliou como a microbiota intestinal poderia estar influenciando na resposta imune a tumores, não por meio de seus próprios metabólitos, mas modificando os produtos microbianos do próprio hospedeiro.
Assim, animais após tratamento com um coquetel de antibióticos (ABX) foram capazes de amenizar o desenvolvimento tumoral em modelo experimental de carcinoma hepatocelular, bem como em modelos de metástase hepática. O efeito da remoção da microbiota intestinal pelo tratamento com ABX foi associado à um maior acúmulo de células NKT no fígado quando comparado àqueles animais que não foram submetidos a antibioticoterapia. Observou-se que se tratava de um efeito protetor hepato-específico, uma vez que no mesmo modelo não foi constatado qualquer alteração na metástase em outros órgãos, como o pulmão. Sabe-se que a maioria das células CXCR6+ hepáticas correspondem ao fenótipo NKT, cujo marcador está associado a sobrevivência e acúmulo destas células no fígado. Nesse sentido, os pesquisadores encontraram um maior número de células NKT CXCR6+ ativadas neste órgão após a abordagem do ABX. Estas células passaram a expressar mais IFN-g contribuindo para a resposta antitumoral. Em concordância com estes achados, observou-se que a deficiência de NKT hepáticas (utilizando animais CD1d-/- ou CXCR6-/-) foi suficiente para que o efeito protetor do tratamento com ABX fosse perdido.
As células endoteliais dos sinusóides hepáticos (LSECs) são importantes produtoras de CXCL16, a única quimiocina ligante de CXCR6. Nesse contexto, constatou-se que a depleção da microbiota intestinal foi capaz de aumentar a produção desse mediador pelas LSECs. Sabendo do papel da CXCL16 na homeostase das células NKT hepáticas e de que bactérias comensais do intestino são conhecidas pelo seu envolvimento no metabolismo de ácidos biliares, os autores buscaram encontrar um link entre esses dois fatores para explicar o efeito anti-tumoral evocado pelo ABX. De modo interessante, constatou-se que os ácidos biliares secundários oriundos do metabolismo mediado pela microbiota reduzem os níveis hepáticos de CXCL16, e que o tratamento com ABX foi capaz de preservar os ácidos biliares primários, os quais induzem um aumento da expressão de CXCL16 pelas LSECs. Esse mecanismo explica o aumento de NKTs no fígado de animais submetidos ao tratamento com ABX, já que CXCL16 é crucial para o acúmulo e sobrevivência dessas células. Assim, demonstrou-se que o tratamento oral com ácidos biliares primários e secundários causaram redução e aumento de metástases hepáticas, respectivamente, estando associado à regulação do acúmulo de NKTs.
Os autores desvendaram ainda que as bactérias comensais do gênero Clostridium (Cluster XIVa) eram as responsáveis por interferir no acúmulo de NKT no fígado, cujo efeito foi abolido pelo potente antibiótico vancomicina. Adicionalmente, por meio de análises de bioinformática, observou-se que existe uma correlação positiva entre o aumento de ácidos biliares primários e a expressão de CXCL16 em espécimes de fígado oriundos de pacientes com carcinoma hepatocelular [3]. Portanto, esse trabalho revela um papel inusitado da microbiota intestinal na prevenção da resposta antitumoral mediada por células NKT. Ainda, esses achados podem indicar um impacto da microbiota na eficácia de imunoterapias contra o câncer.
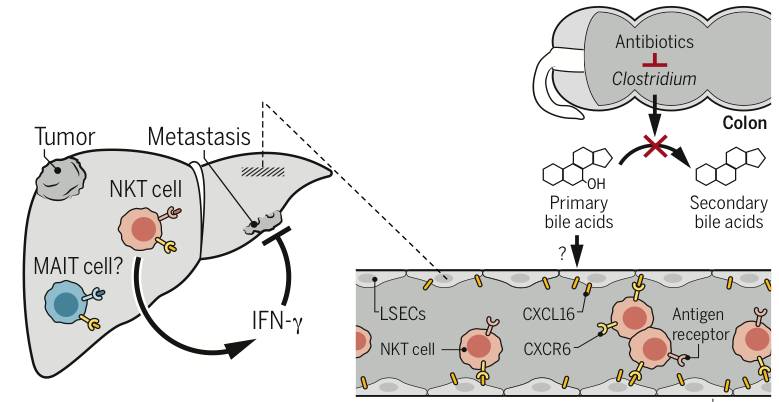
Figura 1. Espécies do gênero Clostridium modificam ácidos biliares, os quais previnem a resposta antitumoral no fígado. Após tratamento com antibiótico, a população de bactérias Clostridium do cluster XIVa são reduzidas, causando diminuição de ácidos biliares secundários e preservando ácidos biliares primários. Estes últimos, aumentam a produção de CXCL16 por LSECs, promovendo acúmulo de células NKT CXCR6+ hepáticas. Estas células produzem citocinas como IFN-g em resposta ao câncer no fígado, por reconhecimento de antígeno ainda não conhecido, contribuindo para inibição do crescimento tumoral. Fonte: adaptado de Hartmann and Kronenberg (2018) [4].
Referências
- FastStats [Internet]. 31 Jan 2018 [cited 16 Aug 2018]. Available: https://www.cdc.gov/nchs/fastats/liver-disease.htm
- Li T, Chiang JYL. Bile acid signaling in metabolic disease and drug therapy. Pharmacol Rev. 2014;66: 948–983. doi:10.1124/pr.113.008201
- Ma C, Han M, Heinrich B, Fu Q, Zhang Q, Sandhu M, et al. Gut microbiome-mediated bile acid metabolism regulates liver cancer via NKT cells. Science. 2018;360. doi:10.1126/science.aan5931
- Hartmann N, Kronenberg M. Cancer immunity thwarted by the microbiome. Science. 2018;360: 858–859. doi:10.1126/science.aat8289

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










