Alunas: Francielle Ferreira e Keise Adrielle Pereira
Editora: Vânia Bonato
GM-CSF–mediated epithelial-immune cell cross-talk orchestrates pulmonary immunity to Aspergillus fumigatus
Kathleen A. M. Mills1, Frederike Westermann2, Vanessa Espinosa3, Eric Rosiek4, Jigar V. Desai5†,Mariano A. Aufiero6, Yahui Guo7,8, Fitty L. Liu1, Kennedy A. Mitchell7,8, Selma Tuzlak2,Donatella De Feo2, Michail S. Lionakis5, Amariliz Rivera3, Burkhard Becher2, Tobias M. Hoh1,6,7,8
DOI: 10.1126/sciimmunol.adr0547
A aspergilose é uma infecção fúngica, e quando invasiva representa grave ameaça, especialmente, para pacientes imunocomprometidos. Ainda não se sabia como o sistema imunológico responde ao Aspergillus fumigatus, agente etiológico dessa doença, nas primeiras horas após a infecção. Esse estudo publicado Science Immunology, em março de 2025, descreveu o protagonismo das células epiteliais pulmonares resposta inata na aspergilose.
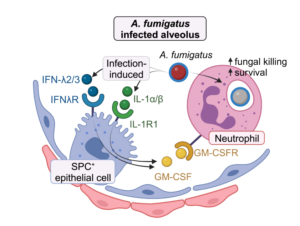
Os autores mostraram que células epiteliais, como os pneumócitos tipo II (AEC-II) e células-tronco brônquicas, expressavam a proteína surfactante C (células SPC⁺) e eram as principais produtoras de GM-CSF (fator estimulador de colônias de granulócitos e macrófagos) durante a infecção. GM-CSF ativou neutrófilos, capacitando-os a matar eficazmente os conídios. Na ausência de GM-CSF, os neutrófilos foram recrutados para o local da infecção, mas não desempenharam função antifúngica.
Para entender como GM-CSF era regulado e atuava na defesa durante a infecção com A. fumigatus, os autores utilizaram modelo murino e mostraram que nos animais selvagens (WT), as concentrações de GM-CSF aumentavam nas fases iniciais da infecção, sendo sua presença essencial para a sobrevivência dos animais. A produção de GM-CSF foi demonstrada como dependente de sinais locais da infecção. Usando camundongos deficientes para as citocinas e receptores de IL-1 e IFN-λ, os autores descobriram que ambas as vias sinalizavam de forma independente para induzir a produção de GM-CSF, evidenciando resposta mais robusta contra a infecção em decorrência de redundância funcional.
Como os resultados obtidos mostraram que ambas AEC-II e células-tronco brônquicas SPC⁺ eram as principais fontes de GM-CSF, usando imunofluorescência, os autores mostraram que as células SPC⁺ produtoras de GM-CSF estavam localizadas próximas tanto dos conídios quanto dos neutrófilos recrutados, revelando uma resposta localizada e precisa.
Usando animais deficientes condicionais, os autores evidenciaram que a ausência de GM-CSF nas células epiteliais ou a deleção do receptor de GM-CSF nos neutrófilos, acentuou a mortalidade dos animais infectados, confirmando que a interação epitélio–neutrófilo, mediada por GM-CSF, era crucial para conter a infecção e evitar a disseminação fúngica pelo tecido pulmonar.
Em conjunto, os dados revelam o papel central das células epiteliais pulmonares SPC⁺ na resposta imunológica inicial contra A. fumigatus. A produção de GM-CSF ocorre em pontos específicos dos pulmões onde o fungo está germinando, formando um circuito de comunicação célula-a-célula extremamente coordenado. Esses achados ajudam a explicar por que pacientes com deficiência na produção ou na sinalização de GM-CSF, como os pacientes que apresentam proteinose alveolar pulmonar, podem ser vulneráveis a infecções fúngicas graves.
Ativação do eixo epitélio–neutrófilo mediado por citocinas durante a infecção alveolar por Aspergillus fumigatus. A produção localizada de GM-CSF por células epiteliais pulmonares SPC⁺, induzida por IL-1 e IFN-λ, ativa neutrófilos próximos ao foco infeccioso. Essa sinalização restrita ao local da infecção otimiza a defesa contra a infecção, contribuindo para a sobrevivência observada na aspergilose experimental.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)