Autores: André Correa e Samuel Oliveira
Editor: Ademilson Panunto Castelo
Seminário apresentado na disciplina Tópicos Avançados de Imunologia do Programa de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP
Em um estudo intitulado “Metabolic coordination between skin epithelium and type 17 immunity sustains chronic skin inflammation”, publicado no periódico Immunity em julho de 2024, Ipsita Subudhi e cols. revelaram como a ativação metabólica do epitélio e a produção de lactato contribuem para a perpetuação da inflamação e a patologia em doenças inflamatórias da pele.
Doenças inflamatórias epiteliais, tal como a psoríase, são caracterizadas por interações patológicas entre células epiteliais e o sistema imunológico. A reprogramação metabólica epitelial, particularmente mediada pelo fator 1α induzível por hipóxia (HIF1α), desempenha um papel crítico nessas doenças. Neste estudo, os autores procuraram desvendar os mecanismos pelos quais o metabolismo epitelial reprogramado, controlado por HIF1α, contribui para a inflamação do tipo 17 através da produção de lactato, e como isso modula a resposta imunológica, especificamente as células T γδ. A investigação se concentrou na resposta inflamatória cutânea em modelos murino e em culturas epiteliais humanas.
Inicialmente, os investigadores confirmaram, através de tecnologias de transcriptômica espacial e de célula única e imunofluorescência, que HIF1α desempenha um papel fundamental na condução da remodelação epitelial na psoríase. Além disso, as análises revelaram que a sinalização exuberante de IL-17A e a expressão associada de HIF1α são efetivamente reduzidas quando uma terapia biológica funciona com sucesso..
Em camundongos, os autores usaram o modelo de inflamação cutânea similar à psoríase por tratamento com imiquimod. Curiosamente, observaram que a deleção do gene de HIF1α em células epiteliais (Hif1αEKO) não alterava significativamente os transcritos de citocinas e quimiocinas em comparação aos camundongos controle. Em biópsias de pele lesionada de pacientes com psoríase, o uso de inibidor de HIF1α também não reduzia a expressão de genes inatos ligados à resposta tipo 17, como CCL20, IL1b, IL6 e IL23A.
Dado que a inibição de HIF1α não afetava diretamente tais transcritos, os pesquisadores hipotetizaram que o fenômeno estava sendo desencadeado indiretamente por um metabólito. Logo, pensaram em um subproduto abundante da glicólise, o lactato, o qual pode aumentar a fosforilação oxidativa nas mitocôndrias e acionar a inflamação tipo 17. De fato, concentrações aumentadas de lactato foram detectadas em organoides epiteliais tratados com IL-17A e em biópsias de pele de camundongos tratados com imiquimod, sendo significativamente reduzidas nas células de biópsias tratadas com bloqueador da glicólise. Além disso, os autores mostraram que animais com deleção específica do gene do transportador de glicose Glut1 em células da epiderme (Slc2a1) estavam completamente protegidos da patologia desencadeada pelo imiquimod, apresentando espessura e proliferação epidérmica significativamente reduzidas.
Para testar diretamente o papel do lactato na inflamação, os autores trataram os camundongos com psoríase-símile de forma tópica com inibidores da produção de lactato: o oxamato de sódio, o qual inibe a lactato desidrogenase A (LDH-A), e a sirosingopina, que bloqueia os transportadores 1 e 4 de monocarboxilato (MCT1 e MCT4). A intervenção diminuiu a espessura do epitélio e a infiltração de células T γδ, mesmo quando aplicada após o início da inflamação. A produção de IL-17A foi reduzida, enquanto a expressão de citocinas de imunidade inata permaneceu inalterada, indicando que o lactato modula especificamente a resposta tipo 17.
Experimentos adicionais com culturas de células T γδ mostraram que o tratamento com L-lactato induzia uma produção de IL-17A significativamente maior do que a das células não tratadas. Concordante com esses experimentos, os autores mostraram que a psoríase-símile induzida por imiquimod era abrandada em camundongos geneticamente modificados que não produziam LDH-A especificamente em células T γδ (LdhaRorcCre), apresentando redução na espessura epitelial, menor número de células T γδ e expressão reduzida de IL-17A quando comparado aos controles não modificados, reforçando o papel do lactato na perpetuação da inflamação tipo 17.
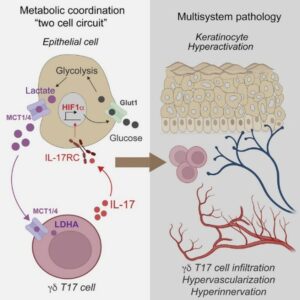
Os resultados deste estudo elucidam que a glicólise epitelial mediada por HIF1α gera lactato, que estimula a produção de IL-17A pelas células T γδ, exacerbando a inflamação tipo 17 (Fig. 1). A inibição da produção ou transporte de lactato mostrou-se eficaz na redução da inflamação cutânea, indicando o metabolismo epitelial como um alvo terapêutico potencial para doenças inflamatórias como a psoríase.
Fig.1 - Na esquerda, observamos o "circuito de duas células" que descreve a interação metabólica entre a célula epitelial e a célula T γδ. A glicose, captada pela célula epitelial via transportador de glicose Glut1, é metabolizada através da glicólise sob o controle do fator HIF1α, resultando na produção de lactato. Este lactato é exportado pelas células epiteliais por meio dos transportadores MCT1/4 e atua diretamente nas células T γδ produtoras de IL-17, que expressam LDHA. O lactato captado pelas células T γδ promove a produção de IL-17, exacerbando a inflamação do tipo 17. À direita, as consequências patológicas desse circuito são ilustradas: hiperativação de queratinócitos, infiltração de células T γδ, hipervascularização e hiperinervação no tecido afetado. Essas alterações estão associadas ao desenvolvimento de doenças inflamatórias da pele, como a psoríase.
Referências
Subudhi I, Konieczny P, Prystupa A, Castillo RL, Sze-Tu E, Xing Y, Rosenblum D, Reznikov I, Sidhu I, Loomis C, Lu CP, Anandasabapathy N, Suárez-Fariñas M, Gudjonsson JE, Tsirigos A, Scher JU, Naik S. Metabolic coordination between skin epithelium and type 17 immunity sustains chronic skin inflammation. Immunity. 2024 Jul 9;57(7):1665-1680.e7. doi: 10.1016/j.immuni.2024.04.022



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)