Autoras: Bruna Manuella e Larissa Andrade
Editora: Daniela Carlos Sartori
Seminário apresentado junto ao Curso de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
O artigo intitulado “Mitochondrial DNA released by senescent tumor cells enhances PMN-MDSC-driven immunosuppression through the cGAS-STING pathway”
A senescência celular é principalmente caracterizada pela interrupção do ciclo celular e subsequente resistência a morte celular programada (apoptose) e um perfil secretor de diversos mediadores associados à senescência (SASP)1,2. Atualmente, a senescência está vinculada ao envelhecimento e desenvolvimento do câncer. O estresse oncogênico, perda de genes supressores de tumor, alterações metabólicas e tratamento antitumoral podem induzir a senescência celular. O processo de senescência altera as funções celulares e morfológicas, principalmente a dinâmica mitocondrial3,4.
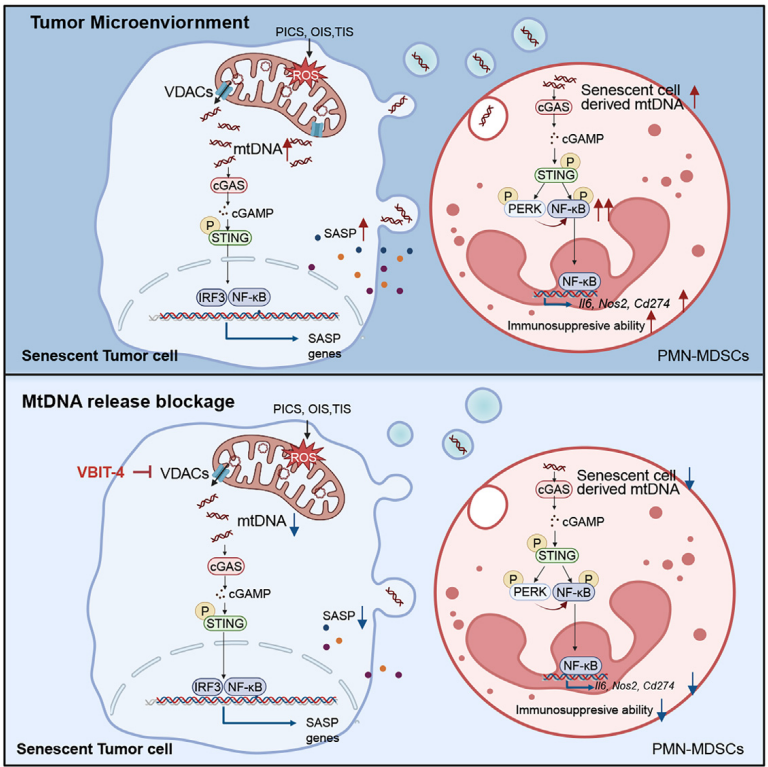
Dentre as mudanças mitocondriais decorrentes da senescência celular está a liberação de DNA mitocondrial (mtDNA). O mtDNA também pode ser liberado por lesões teciduais, doenças inflamatórias e câncer, sendo reconhecido como padrões moleculares associados a danos, (DAMP), que são moléculas endógenas liberadas por células danificadas ou estressadas, podendo também ativar respostas inflamatórias através do receptor Toll-like 9, da sintase cíclica de GMP-AMP (cGAS) ou do inflamassoma NLRP35. No artigo, foi investigado como as células senescentes liberam mtDNA no espaço extracelular e os efeitos pró-tumorais do mtDNA exógeno na progressão tumoral.
Usando três modelos diferentes de senescência — senescência celular induzida por perda do gene supressor de tumor PTEN (PICS), senescência induzida por oncogene (OIS) e senescência induzida por palbociclibe (senescência induzida por terapia ou TIS) — foi descoberto que as células senescentes liberam mtDNA no espaço extracelular. O mtDNA citosólico foi acondicionado em vesículas extracelulares (VEs) e liberado no microambiente tumoral, onde foi internalizado seletivamente por células supressoras derivadas de mieloides polimorfonucleares (PMN-MDSCs, também conhecidas como G-MDSCs), um subconjunto de células altamente imunossupressoras presentes no câncer de próstata1,6,7.
O mtDNA capturado por PMN-MDSCs aumentou a sua função imunossupressora, promovendo a progressão tumoral e a resistência ao tratamento através da via cGAS-STING e NF-κB. Foi demonstrado que o mtDNA de células senescentes é liberado por meio de canais aniônicos dependentes de voltagem (VDACs). De acordo com esses dados, ao inibir farmacologicamente o canal do VDAC em células tumorais senescentes não ocorreu a liberação intracelular e exógena do mtDNA, consequentemente prevenindo a imunossupressão mediada por PMN-MDSC e restaurando a imunidade antitumoral. Essas descobertas destacam um novo mecanismo pelo qual as células senescentes contribuem para a evasão tumoral da resposta imune e sugerem que direcionar (ou bloquear/inibir) a liberação de mtDNA pode ser uma estratégia promissora para reprogramar o microambiente tumoral imunossupressor.
Figura 1. O processo de senescência induz a liberação de mtDNA, os quais são entregues para PMN-MDSCs por meio de vesículas extracelulares. Esse processo induz ativação da via cGAS-STING-NF-κB, o que favorece o desenvolvimento e manutenção do microambiente tumoral.
Referências
- Calcinotto, C. Spataro, E. Zagato, D. Di Mitri, V. Gil, M. Crespo, G. De Bernardis, M. Losa, M. Mirenda, E. Pasquini, et al. IL-23 secreted by myeloid cells drives castration-resistant prostate câncer Nature, 559 (2018), pp. 363-369, 10.1038/s41586-018-0266-0
- Demaria, M.N. O'Leary, J. Chang, L. Shao, S. Liu, F. Alimirah, K. Koenig, C. Le, N. Mitin, A.M. Deal, et al. Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse Cancer Discov., 7 (2017), pp. 165-176, 10.1158/2159-8290.CD-16-0241
- Hernandez-Segura, J. Nehme, M. Demaria Hallmarks of Cellular Senescence Trends Cell Biol., 28 (2018), pp. 436-453, 10.1016/j.tcb.2018.02.001
- Martini, J.F. Passos Cellular senescence: all roads lead to mitochondria FEBS Journal, 290 (2023), pp. 1186-1202, 10.1111/febs.16361
- P. West, G.S. Shadel. Mitochondrial DNA in innate immune responses and inflammatory pathology. Nat. Rev. Immunol., 17 (2017), pp. 363-375, 10.1038/nri.2017.21
- DiMitri, A. Toso, J.J. Chen, M. Sarti, S. Pinton, T.R. Jost, R. D’Antuono, E. Montani, R. Garcia-Escudero, I. Guccini, et al. Tumour-infiltrating Gr-1+ myeloid cells antagonize senescence in câncer Nature, 515 (2014), pp. 134-137, 10.1038/nature13638
- Toso, A. Revandkar, D. DiMitri, I. Guccini, M. Proietti, M. Sarti, S. Pinton, J. Zhang, M. Kalathur, G. Civenni, et al. Enhancing chemotherapy efficacy in Pten-deficient prostate tumors by activating the senescence-associated antitumor immunity



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)