As células do nosso sistema imunológico inato, como macrófagos, neutrófilos, monócitos e células dendríticas, apresentam estruturas em diferentes compartimentos, que possibilitam o reconhecimento de moléculas expressas nos patógenos (1). Essas estruturas são chamadas de Receptores de Reconhecimento de Padrões ou PRRs (Pattern Recognition Receptors). Dentre os PRRs amplamente estudados destacam-se: Toll-Like Receptors (TLRs), C-type Lectin Receptors (CLRs) (localizados na membrana plasmática ou membrana endossomal), Nod-Like Receptors (NLRs), Aim-Like Receptors (ALRs) e RIG-Like Receptors (RLRs) (localizados no citoplasma) (2). A iteração destes receptores a seus ligantes induz a ativação de cascatas de sinalização intracelular que culminam na transcrição e produção de citocinas pró-inflamatórias.
Estudos bioquímicos e estruturais recentes demonstram que os PRRs compartilham estruturas que promovem a transdução de sinais. Por exemplo, os PRRs das famílias TLRs, NLRs e RLRs medeiam a formação de complexos de proteínas oligoméricas, que consistem de um receptor, uma proteína adaptadora, e uma enzima efetora. Os TLRs possuem como proteína adaptadora, as proteínas Myd88 e TRIF, e quinases da família IRAK, como enzimas efetoras. A ativação destes receptores leva a formação de um complexo oligomérico chamado mydossomo. Já os receptores NLRs possuem a proteína ASC como proteína adaptadora e a enzima caspase-1, como enzima efetora, e ao serem ativados formam um complexo oligomérico chamado inflamassoma (3).
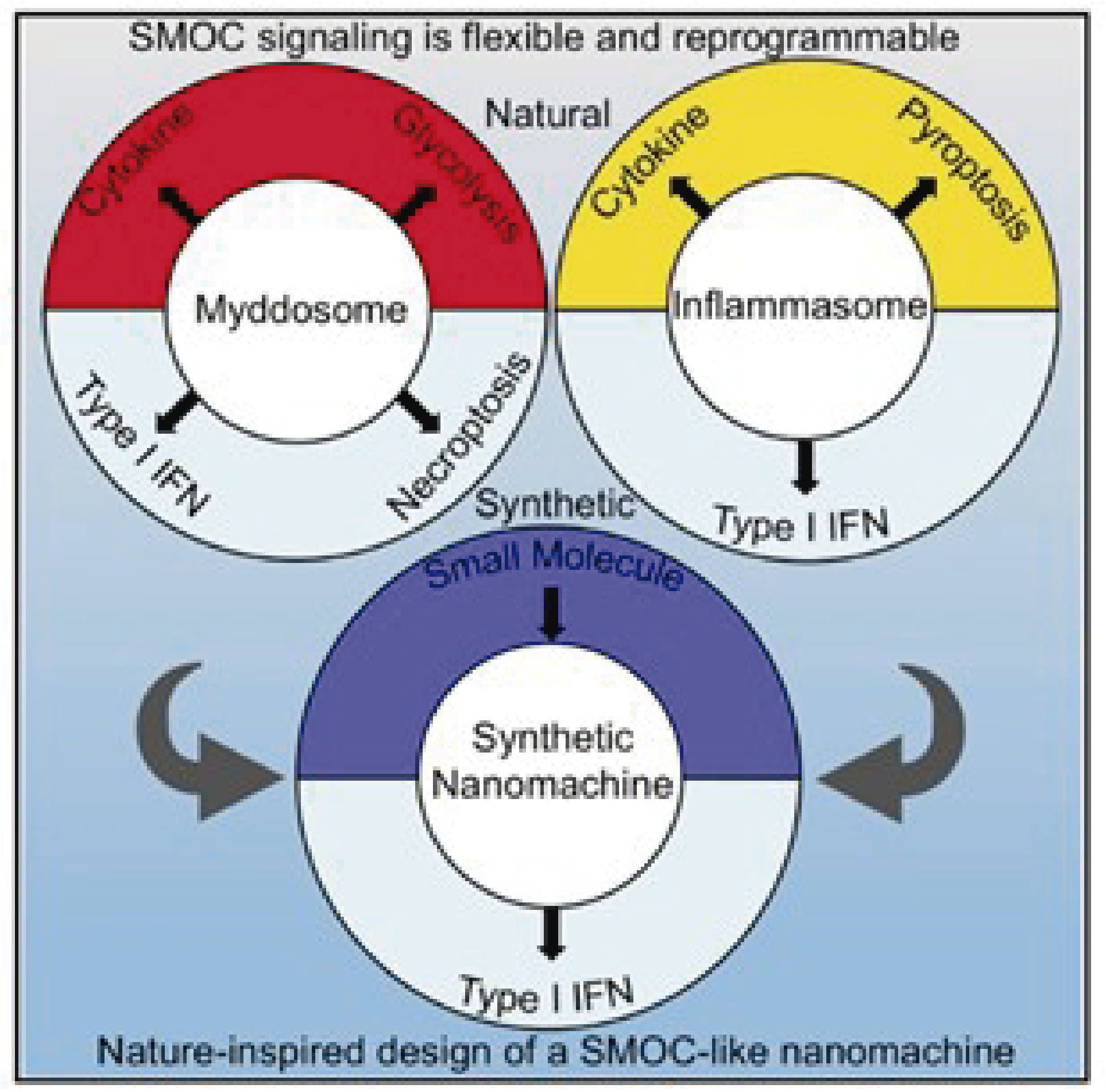
A partir da ideia de que os diferentes PRRs possuem estruturas compartilhadas para promover a transdução de sinais, surgiu a hipótese de que estes receptores ao serem ativados podem formar complexos multiproteicos com capacidade de oligomerização para promover a transdução de sinais. Este complexo é chamado de Supramolecular Organizing Centers (SMOCs). Os SMOCs incluem os complexos oligoméricos Mydossomo, Inflamassoma e RIG-Like Receptors (3).
Neste sentido, Yunhao Tan e Jonathan Kagan (2019) quiseram aprofundar nos sinais moleculares que são iniciados após os TLRs serem ativados por seus respectivos agonistas. Os autores identificaram que a proteína TBK1 que nunca tinha sido associada com a via de Myd88, não só era recrutada por esta, como também induzia mudança metabólica significativa nos macrófagos ativados.
Esse resultado levou os autores a pensar que as funções de Myd88 vão muito além de recrutar proteínas. Os autores mostraram que Myd88 é parte de uma complexa organela de sinalização (SMOC) que regula os sinais de ativação das vias de TLRs. Para testar essa hipótese e usando ferramentas de engenharia genética, foi possível desenhar um alelo quimérico onde a proteína Myd88 poderia ter acoplado em seu extremo proteico, um receptor de sinalização diferente, como STING, e dessa maneira, fazer que na presença de determinados estímulos, o macrófago produzisse IFN-β. Diferentemente, no lugar de STING acoplar RIP3, dessa maneira, induzindo morte celular por necroptose.
Tendo em mente que o inflamasoma também é um SMOC, e que depende de uma complexa rede de interações moleculares que promovem ativação das caspases e produção de citocinas e/ou morte celular por piroptose, os autores desenharam um alelo modificado de caspase 1 que não só estava inativo como também era incapaz de gerar morte celular. Além disso, essa caspase 1 inativa apresentava o domínio catalítico do STING, possibilitando a produção de IFN-β após ativação do inflamassoma. Os resultados conjuntos dos autores mostram que os SMOC podem ser manipulados para acoplar uma maquinaria diferente e, dessa maneira, gerar uma resposta dirigida.
Para testar essas hipóteses em um conceito mais claro, os autores criaram sinteticamente um SMOC que era capaz de dirigir a expressão de IFN-I em resposta a pequenas moléculas. Esse basicamente consistia em induzir a oligomerização de uma proteína modificada para ter em seu extremo o domínio catalítico de STING e desse jeito produzir citocinas pré-determinadas pelo usuário. Este elegante trabalho traz uma grande novidade por demonstrar que a indução das respostas inflamatórias necessitam da formação de complexos multiproteicos, que embora diferentes, podem partir de moléculas compartilhadas pela vias distintas de sinalização.
Referências
- Pandey, S., Kawai, T., and Akira, S. (2014). Microbial sensing by Toll-like re- ceptors and intracellular nucleic acid sensors. Cold Spring Harb. Perspect. Biol. 7, a016246.
- Brubaker, S.W., Bonham, K.S., Zanoni, I., and Kagan, J.C. (2015). Innate im- mune pattern recognition: a cell biological perspective. Annu. Rev. Immunol. 33, 257–290.
- Kagan, J.C., Magupalli, V.G., and Wu, H. (2014). SMOCs: supramolecular organizing centres that control innate immunity. Rev. Immunol. 14, 821–826.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)