Cristhiane Favero de Aguiar
Pós Doutoranda do Laboratório de Imunometabolismo,
Editor Chefe: Prof. Pedro Moraes-Vieira
Instituto de Biologia
UNICAMP
Ninguém, por enquanto... Isso não significa que nada possa alterar o seu DNA. Há muito tempo sabemos, por exemplo, que raios ultravioleta provenientes da luz solar podem causar lesões no DNA. Só que mais recentemente, começaram a surgir as especulações e notícias falsas de que as vacinas de mRNA contra a COVID-19 poderiam alterar nosso DNA.
O DNA é a molécula que carrega a informação necessária para todas as funções de uma célula. Por ser tão precioso e importante, ele é muito bem “guardado” no núcleo da célula e muito bem protegido por mecanismos de reparo, de forma que conseguimos corrigir muitos dos danos que acontecem nele. Então, não é tarefa fácil alterar o DNA.
As vacinas de material genético desenvolvidas para prevenir a COVID-19 são de um RNA mensageiro, que é apenas um pedaço de informação para fazer uma única proteína, no caso a spike do coronavírus. O mRNA não vai para dentro do núcleo da célula, portanto, ele não tem chance de fazer qualquer alteração no DNA.
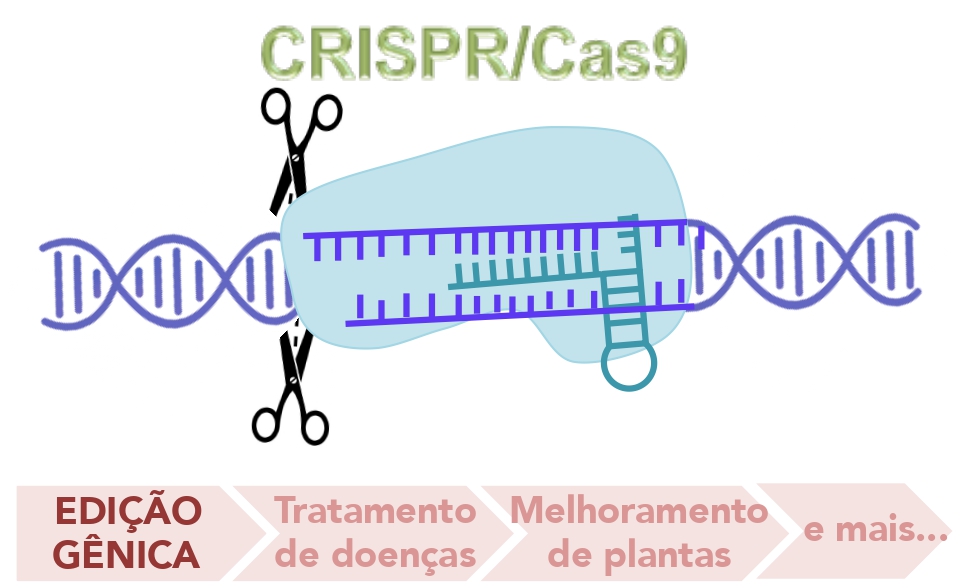
Deixando um pouco as vacinas de lado, já que elas não modificam nosso DNA, e voltando para a dificuldade em se alterar o DNA de alguém, tivemos em 2020 a consagração de uma tecnologia muito inovadora, a Crispr/Cas9. Jennifer Doudna e Emmanuelle Charpentier receberam o Prêmio Nobel de Química no ano passado pelo desenvolvimento dessa tecnologia de edição genômica.
As técnicas de edição genômica não são novidade. Há algum tempo elas já são usadas, embora sejam muito mais custosas. Mas o que torna a técnica de CRISPR-Cas9 tão peculiar a ponto de ser consagrada com um prêmio Nobel?
CRISPR/Cas9 significa repetições curtas palindrômicas agrupadas e regularmente espaçadas (do inglês, Clustered regularly interspaced short palindromic repeats)/Proteína 9 associada a Crispr (Cas9, do inglês Crispr-associated protein 9) e é um complexo formado por essa proteína Cas9 e uma molécula de RNA guia. A proteína Cas9 (uma endonuclease) é capaz de cortar a dupla fita de DNA em regiões específicas determinadas pelo pareamento do RNA guia. Dessa forma, essa técnica consegue ter uma precisão na região a ser alterada muito grande, além de ser mais rápida, versátil e acessível. Ela foi descoberta em bactérias, que possuem esse sistema como um forma de imunidade “adaptativa” contra vírus e adaptada para edição gênica em humanos, animais e plantas.
A técnica tem revolucionado a edição gênica, porém, os cientistas ainda encontram dificuldades em alguns pontos. Muitas das alterações genéticas que tem maior sucesso são feitas no estágio embrionário mais inicial, de uma única célula. Se a alteração é incorporada ao DNA adequadamente, a chance de que a maioria das células filhas tenham essa alteração é muito grande. E isso é feito mais extensivamente em modelos animais, como camundongos, para entender os mecanismos de várias doenças. Por questões éticas, esse tipo de manipulação em embriões humanos não pode ser feita para fins reprodutivos. No entanto, no fim de 2018, um pesquisador chinês revelou ter feito alterações no gene CCR5 (utilizando a técnica Crispr/Cas9) de dois embriões, que foram implantados e geraram duas bebês. O pesquisador foi duramente criticado pelo risco e precocidade no uso da técnica e também demitido e condenado a 3 anos de prisão. Pesquisadores que tiveram acesso a parte dos dados da pesquisa ressaltaram que talvez a edição genética não foi totalmente sucedida, pois nem todas as células das bebês teriam essa alteração. Assim, a prerrogativa de gerar uma resistência ao HIV (já que esse vírus usa o receptor CCR5 como co-receptor para infectar as células) pode não ter sido atingida, visto que parte das células ainda estariam suscetíveis por não terem a edição.
Outro ponto é que é bem mais difícil conseguir alterar o DNA em células de organismos adultos, pois em algumas formas de alteração, a técnica de Crispr/Cas9 depende das células entrarem em divisão e grande parte das nossas células está em um estado quiescente. Entretanto, estudos e testes clínicos já são realizados para testar a segurança e eficiência da técnica para tratar doenças genéticas humanas. Em alguns casos, células do sangue são retiradas da pessoa, editadas em laboratório para depois serem reintroduzidas com a modificação, como por exemplo, para tentar corrigir mutações em doenças como a anemia falciforme e a beta talassemia. No ano passado, porém, o primeiro teste clínico para avaliar o tratamento por edição genética Crispr/Cas9 injetado diretamente no corpo foi iniciado. A terapia foi pensada para corrigir uma mutação que causa cegueira, uma condição chamada amaurose congênita de Leber. Nesse caso, os componentes do sistema de edição são introduzidos diretamente no olho dos pacientes para tentar reativar o gene defeituoso nas células fotorreceptoras. Esses testes clínicos seguem em andamento mas já tem dado resultados muito interessantes e promissores com diminuição de sintomas nos casos de anemia falciforme e beta talassemia.
No fim das contas, não é tão fácil alterar o DNA, principalmente o nosso (humano), tanto no quesito técnico quanto no ético. Mas talvez no quesito técnico os avanços venham muito mais rápidos e nos deixem com a faca e o queijo na mão para usar essas novas tecnologias para prevenir e tratar doenças genéticas, ou então, termos uma faca de dois gumes e utilizá-la indevidamente. Fica então a dica para valorizarmos a ciência e os princípios éticos que permeiam o uso de novas tecnologias e buscarmos sempre informações. E assim, quando a próxima corrente do whatsapp chegar a você sobre estarem tentando alterar seu DNA de alguma forma, leve em consideração que isso não é tarefa fácil!
Artigos e links:
https://revistapesquisa.fapesp.br/ferramenta-para-editar-genes-leva-o-premio-de-quimica/
https://science.sciencemag.org/content/337/6096/816 DOI: 10.1126/science.1225829
https://www.nature.com/articles/d41586-019-00673-1
https://www.nature.com/articles/d41586-020-00655-8
https://doi.org/10.1016/j.jhepr.2019.09.002
https://www.technologyreview.com/2019/12/03/65024/crispr-baby-twins-lulu-and-nana-what-happened/
https://www.nejm.org/doi/full/10.1056/NEJMoa2031054 DOI:10.1056/NEJMoa2031054



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)











1 Comentários
Excelentes esclarecimentos sobre Imunologia e Genética.