Lições do grande professor Susumu Tonegawa sobre recombinação somática contribuem, até hoje, para grandes descobertas, não apenas no campo da Imunologia. Ao que tudo indica, a recombinação somática também está presente nos neurônios!
Por Maurício Menegatti Rigo, Ph.D.
Setembro de 1939. Iniciava-se a Segunda Guerra Mundial. No mesmo mês, do mesmo ano, na cidade de Nagoya (Japão), nascia um futuro ganhador do prêmio Nobel - Susumu Tonegawa. Embora tenha crescido em um ambiente de intensas discussões políticas, polarizadas entre pró-americanos conservadores e esquerdistas antimilitares, Susumu Tonegawa foi apenas um participante passivo. Não que isso não o tenha influenciado, pelo contrário, muito provavelmente foi a conjuntura do momento que o fez desistir dos interesses em engenharia química em prol de uma carreira acadêmica [1]. Do Japão, mudou-se para os Estados Unidos, onde obteve seu Ph.D. e pós-doutorado. Passando por renomadas instituições americanas como a UCSD e o The Salt Institute, Susumu Tonegawa desenvolveu intenso interesse pela área de biologia molecular, trabalhando com organismos procariotos e eucariotos. Como seu visto americano estava prestes a expirar, teve que procurar outra instituição para trabalhar. Queria o destino que ele imergisse em uma nova área - a da imunologia - uma vez que recebeu uma oferta de trabalho para atuar no Basel Institute for Immunology, na Suíça. Embora inicialmente desconfortável por estar pisando em terreno desconhecido, Susumu Tonegawa tentou aliar o útil ao agradável, unindo os conhecimentos adquiridos no campo da biologia molecular com os desafios impostos pela imunologia. E que baita desafio ele escolheu: diversidade de anticorpos. Até então não se sabia exatamente como centenas de milhões de diferentes anticorpos com diferentes especificidades poderiam ser produzidos oriundos de uma quantidade muito menor de material genético. Mas Susumu Tonegawa, utilizando técnicas simples se considerarmos os dias atuais, mostrou que o DNA de linfócitos B podia se rearranjar de modo a produzir variantes genéticas compatíveis com a diversidade observada a nível de aminoácidos na região Fab de diferentes anticorpos. Os linfócitos B estavam, simplesmente, recombinando-se a nível de DNA, uma novidade para a época [2]! Através de um mecanismo de excisão e junção de éxons em regiões denominadas V, D e J os linfócitos podiam gerar diversidade, inclusive descartando DNA, se necessário fosse (Figura 1). O impacto da pesquisa foi tão grande que Susumu Tonegawa ganhou o Prêmio Nobel em Fisiologia e Medicina em 1987.
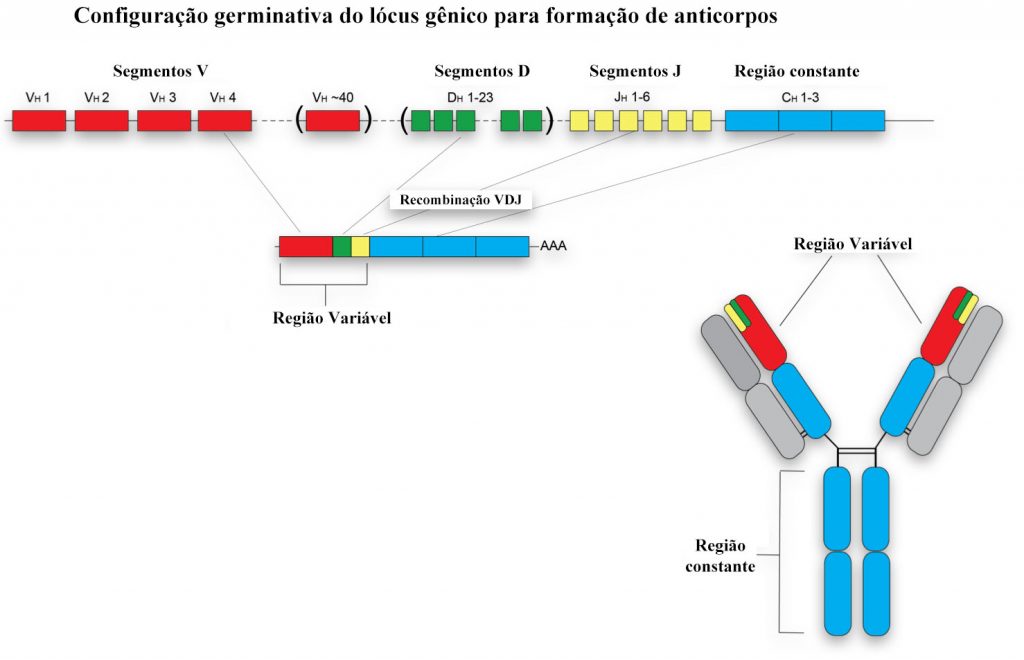
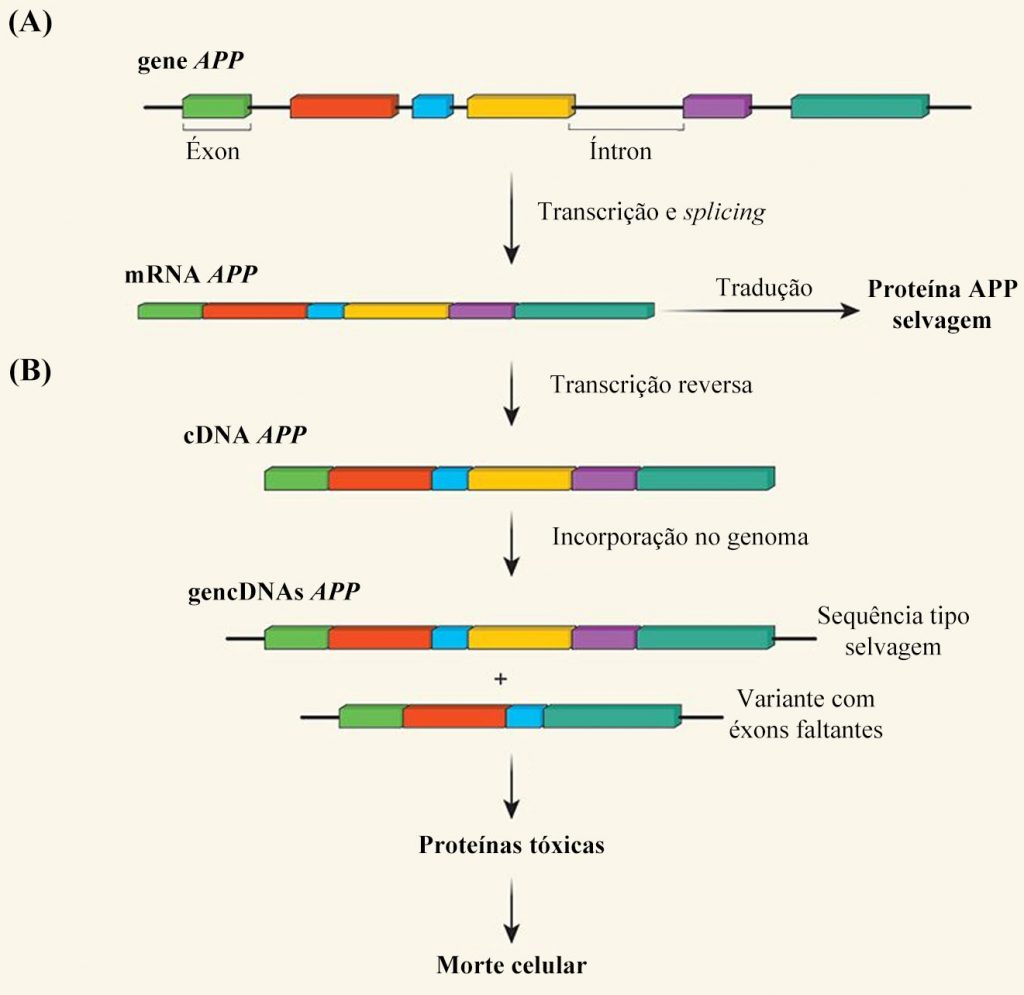
Uma das coisas incríveis da ciência é a interdisciplinaridade e a interseção do conhecimento entre diferentes áreas. No início dos anos 2000, também na UCSD e no Instituto de Pesquisa Scripps dos Estados Unidos, o neurocientista brasileiro Stevens Rehen, trabalhando no grupo liderado por Jerold Chun, perseguia a hipótese de que neurônios humanos seriam capazes de reorganizar o seu DNA, similar ao que acontecia nos linfócitos B. Na época, com a tecnologia disponível, acharam evidências que dariam suporte a essa hipótese, indicando que o Sistema Nervoso Central (SNC), durante o desenvolvimento e a idade adulta, seria composto por um mosaico genético: uma população euploide misturada com uma pequena, mas geneticamente diversa, população aneuploide [4,5]. Tais perdas e ganhos de material genético nesses neurônios influenciariam o destino do cérebro e o desenvolvimento de importantes patologias, como a doença de Alzheimer, por exemplo [6,7]. No último dia 21 de novembro, pouco mais de 15 anos depois que as pesquisas sobre o assunto foram iniciadas, mas agora com ferramentas mais avançadas, a nova equipe liderada pelo professor Jerold Chun publicou resultados realmente incríveis relacionados ao gene APP, um importante gene associado ao desenvolvimento da doença de Alzheimer [8]. Primeiramente, o grupo identificou variantes de mRNA de APP. Essas variantes, entretanto, quando comparadas ao DNA do qual elas deveriam ser originadas, eram menores do que o esperado e continham mutações nucleotídicas únicas e grandes deleções que levavam a formação de novas junções éxon-éxon. Uma análise mais profunda mostrou que haviam variantes do DNA nos neurônios, compatíveis com as variantes de mRNA encontradas, sugerindo uma relação entre o transcrito e a sequência genômica. Os autores alcunharam o termo gencDNAs para se referir a essas sequências genômicas complementares de DNA. A seguir, os autores investigaram a extensão da diversidade de gencDNAs em células de indivíduos saudáveis e de pacientes com doença de Alzheimer. Eles encontraram muito mais variantes de gencDNAs nos pacientes (10 vezes mais, se comparado com indivíduos saudáveis). Usando um modelo murino de doença de Alzheimer, observaram que essas variantes eram mais frequentes em células neuronais se comparado com células não neuronais. Qual não foi a surpresa quando constataram que tais variantes tinham um efeito cumulativo com a idade e que seu produto apresentara efeitos tóxicos em experimentos de transfecção e avaliação da viabilidade celular.
Mas uma questão ainda estava em aberto: como os gencDNAs, sem íntrons e complementares às variantes de mRNA, estavam presentes no DNA genômico? Experimentos realizados pelos próprios autores mostraram a atuação de uma transcriptase reversa, a qual seria responsável pela formação dos gencDNAs a partir das suas respectivas variantes no mRNA. Os gencDNAs recém-formados poderiam se inserir no próprio DNA genômico - contanto que houvessem quebras na fita de DNA -, inserção esta observada in vitro e in vivo (Figura 2).
Quebras da fita de DNA [9,10,11], bem como a presença da transcriptase reversa [8], são possíveis de ocorrer no córtex pré-frontal de cérebros humanos. Portanto, aqui abre-se uma nova esperança no tratamento da doença de Alzheimer, uma vez que a transcriptase reversa poderia ser inibida com a utilização de um fármaco já utilizado no tratamento de pacientes soropositivos para HIV: o famoso AZT! É claro que isso precisa ser testado e validado, mas reforçando esse pressuposto, são raros os casos provados de doença de Alzheimer em indivíduos com 65 anos ou mais portadores do vírus HIV [12,13].
O trabalho liderado pelo professor Jerold Chun revelou o fenômeno de recombinação somática em células neuronais, fenômeno este que até então havia sido observado apenas em células do sistema imunológico, por Susumu Tonegawa. É claro que muitas questões ainda ficam abertas como, por exemplo, se o acúmulo do gencDNAs nos neurônios é uma causa ou uma consequência da doença de Alzheimer. Mas assim caminhamos na estrada da ciência. Testando hipóteses, criando evidências, questionando nossos próprios resultados. Às vezes damos passos pequenos, às vezes damos passos maiores, às vezes parece que não saímos do lugar. Mas sempre olhando para frente, sem esquecer dos ensinamentos passados.
Referências
[1] The Nobel Prize in Physiology or Medicine 1987. Disponível em: <https://www.nobelprize.org/prizes/medicine/1987/tonegawa/biographical/>. Acesso em 23 de novembro de 2018.
[2] Tonegawa S. Somatic generation of antibody diversity. Nature. 1983; 302(5909):575-81.
[3] Laboratory for Systems and Synthetic Immunology. Disponível em <https://www.bsse.ethz.ch/lsi/research/systems-immunology.html>. Acesso em 24 de novembro de 2018.
[3] Stevens K. Rehen, Yun C. Yung, Matthew P. McCreight, Dhruv Kaushal, Amy H. Yang, Beatriz S. V. Almeida, Marcy A. Kingsbury, Kátia M. S. Cabral, Michael J. McConnell, Brigitte Anliker, Marisa Fontanoz and Jerold Chun. Constitutional Aneuploidy in the Normal Human Brain. Journal of Neuroscience. 2005; 25(9)2176-2180.
[4] Stevens Rehen, Michael J. McConnell, Dhruv Kaushal, Marcy A. Kingsbury, Amy H. Yang, and Jerold Chun. Chromosomal variation in neurons of the developing and adult mammalian nervous system. PNAS. 2001; 98(23)13361-13366.
[5] Suzanne E. Peterson, Amy H. Yang, Diane M. Bushman, Jurjen W. Westra, Yun C. Yung, Serena Barral, Tetsuji Mutoh, Stevens K. Rehen and Jerold Chun. Aneuploid Cells Are Differentially Susceptible to Caspase-Mediated Death during Embryonic Cerebral Cortical Development. Journal of Neuroscience. 2012; 32(46)16213-16222.
[6] Diane M Bushman, Gwendolyn E Kaeser, Benjamin Siddoway, Jurgen W Westra, Richard R Rivera, Stevens K Rehen, Yun C Yung, Jerold Chun. Genomic mosaicism with increased amyloid precursor protein (APP) gene copy number in single neurons from sporadic Alzheimer's disease brains. eLife. 2015; 4:e05116.
[7] Lee, M.-H., Siddoway, B., Kaeser, G. E., Segota, I., Rivera, R., Romanow, W. J., Christine S. Liu, Chris Park, Grace Kennedy, Tao LongChun, J. Somatic APP gene recombination in Alzheimer’s disease and normal neurons. Nature. 2018 [Epub ahead of print].
[8] Suberbielle, E. et al. Physiologic brain activity causes DNA double-strand breaks in neurons, with exacerbation by amyloid-β. Nat. Neurosci. 2013; 16, 613–621.
[9] Mortimer, J. A., French, L. R., Hutton, J. T. & Schuman, L. M. Head injury as a risk factor for Alzheimer’s disease. Neurology. 1985; 35, 264–267.
[10] Pravdenkova, S. V., Basnakian, A. G., James, S. J. & Andersen, B. J. DNA fragmentation and nuclear endonuclease activity in rat brain after severe closed head injury. Brain Res. 1996; 729, 151–155.
[11] Turner, R. S. et al. An individual with human immunodefciency virus, dementia, and central nervous system amyloid deposition. Alzheimers Dement. 2016; 4, 1–5.
[12] Centers for Disease Control and Prevention. HIV Surveillance Report, 2016 Vol. 28 http://www.cdc.gov/hiv/library/reports/hiv-surveillance.html (2017).
[13] News and Views - A newly discovered mechanism driving neuronal mutations in Alzheimer’s disease. Disponível em: <https://www.nature.com/articles/d41586-018-07334-9#ref-CR8>. Acesso em 24 de novembro de 2018.

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










