Autores: Hellen Anastácia da Silva Soares e Fernanda Mesquita de Souza
Editado por Vanessa Carregaro
O sistema nervoso simpático (SNS) controla diversos processos biológicos involuntários, sendo responsável pela resposta de "luta ou fuga" provocada pelo estresse agudo. A maioria dos tecidos são inervados por fibras do SNS e diversos tipos celulares respondem ao neurotransmissor (NT) noradrenalina por apresentarem receptores adrenérgicos (ARs) α e β (1, 2, 3). Estudos apontam que a ativação do SNS induzida por estresse pode influenciar as respostas imunológicas (4), visto que a estimulação aguda dos ARs aumenta neutrófilos e células natural killer (NK) no sangue, o que possivelmente prepara o corpo para possíveis lesões ou infecções (5). Já a simpatectomia murina promove aumento das respostas antivirais de células T CD8+ frente à infecção por Influenza A (6), demonstrando o impacto do SNS sobre mecanismos efetores imunes. Para avaliar de modo mecanístico o impacto do estímulo do SNS sobre a função dos leucócitos, por meio de microscopia intravital, Devi e colaboradores (7) mostraram que a ativação desse sistema leva à redução da motilidade de linfócitos T CD4+ e T CD8+ nos linfonodos por aproximadamente 60 minutos após o estímulo. Linfócitos T CD8+ de órgãos, como pele e fígado, também foram avaliados e apresentaram o mesmo comportamento observado nos linfonodos. A ativação do sistema nervoso parassimpático, por sua vez, não apresentou efeito na motilidade dessas células. Usando agonistas e antagonistas adrenérgicos, os autores mostraram a participação dos receptores α1 e β2 nesse processo. Ensaios de quimera e de transferência adotiva excluíram a participação do receptor β2 adrenérgico em células hematopoiéticas, o que levou os pesquisadores a avaliarem a participação da vasoconstrição, que é resultante da ativação do SNS nesse processo.
A vasoconstrição tem como efeito a redução do fluxo sanguíneo, promovendo a redução da oxigenação local e, consequentemente, afetando a motilidade dos leucócitos (7,8). De fato, a ativação do SNS em culturas explante de linfonodos, na presença de oxigênio, não alterou a motilidade dos leucócitos. A participação do SNS nesse desfecho foi confirmada após o uso de modelo animal, na qual a ativação do SNS estava submetida à administração de uma molécula capaz de ativar somente nervos simpáticos. Após a ativação desse sistema, foram observadas vasoconstrição e perda da motilidade de linfócitos T CD8+ nos linfonodos. Para confirmar a redução da oxigenação local, uma sonda que se liga às células em condições de hipóxia foi administrada nos animais. A ativação do SNS levou à ligação dessa sonda nos linfócitos, determinada pelo aumento da intensidade de fluorescência média (MFI). Como consequência do ambiente de hipóxia, foi evidenciado ainda, aumento da sinalização de cálcio local, caracterizado pela expressão do sensor de cálcio GCaMP6s nos linfonodos. O aumento dos níveis de cálcio local foi detectado concomitante à perda da motilidade celular observada. Já em condições de normóxia, os linfonodos em cultura explante não apresentaram aumento na sinalização de cálcio intracelular. Para avaliar as consequências da imotilidade dos leucócitos, animais foram desafiados com células tumorais oriundas de melanoma B16-OVA, o vírus herpes simplex virus type 1 (HSV), ou com o protozoário Plasmodium berguei, causador de malária cerebral, e o impacto da hipóxia sobre a resposta imune foi avaliado após a ativação do SNS. Os autores observaram que tais animais apresentaram redução da proliferação de células T CD8+, assim como redução da frequência e número dessas células nos órgãos linfoides. Ainda, animais desafiados com Plasmodium berguei também apresentaram aumento da parasitemia.
Em resumo, os autores trouxeram de modo detalhado como o processo de ativação do SNS pode levar, através de vasoconstrição, redução do fluxo sanguíneo, gerando hipóxia e aumento da sinalização de cálcio, refletindo na imotilidade leucocitária, que resultou em efeitos deletérios para indução da resposta imune (Figura 1).
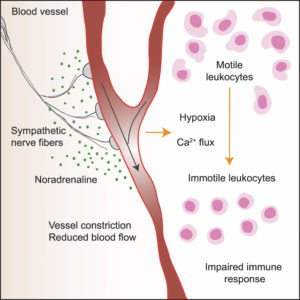
Figura 1. Delineamento experimental do estudo. Indivíduos saudáveis nunca expostos ao vírus da febre amarela foram vacinados e tiveram amostras do sangue coletadas. Análises pré e pós-vacinação demonstraram grande número de células T CD4 de memória preexistente nas amostras anterior a vacinação, entretanto, após a vacinação, essa população dá lugar a populações de células T CD4, que inicialmente eram raras, porém, possuem maior diversidade de receptores e tiveram maior magnitude de expansão.
- FELTEN, D. L.; LIVNAT, S.; FELTEN, S. Y.; CARLSON, S. L.; BELLINGER, D. L.; YEH, P. Sympathetic innervation of lymph nodes in mice. Brain Res Bull. 1984 Dec;13(6):693-9. doi: 10.1016/0361-9230(84)90230-2. PMID: 6532515.
- SLOAN, E. K.; CAPITANIO, J. P.; TARARA, R. P.; MENDOZA, S. P.; MASON, W. A.; COLE, S. W. Social stress enhances sympathetic innervation of primate lymph nodes: mechanisms and implications for viral pathogenesis. J Neurosci. 2007 Aug 15;27(33):8857-65. doi: 10.1523/JNEUROSCI.1247-07.2007. PMID: 17699667; PMCID: PMC6672171.
- ELENKOV, I. J.; WILDER, R. L.; CHROUSOS, G. P.; VIZI, E. S. The sympathetic nerve an integrative interface between two supersystems: the brain and the immune system. Pharmacol Rev. 2000 Dec;52(4):595-638. PMID: 11121511.
- SEGERSTROM, S. C.; MILLER, G. E. Psychological stress and the human immune system: a meta-analytic study of 30 years of inquiry. Psychol Bull. 2004 Jul;130(4):601-30. doi: 10.1037/0033-2909.130.4.601. PMID: 15250815; PMCID: PMC1361287.
- BENSCHOP, R. J.; RODRIGUEZ-FEUERHAHN, M.; SCHEDLOWSKI, M. Catecholamine-induced leukocytosis: early observations, current research, and future directions. Brain Behav Immun. 1996 Jun;10(2):77-91. doi: 10.1006/brbi.1996.0009. PMID: 8811932.
- GREBE, K. M.; HICKMAN, H. D.; IRVINE, K. R.; TAKEDA, K.; BENNINK, J. R.; YEWDELL, J. W. Sympathetic nervous system control of anti-influenza CD8+ T cell responses. Proc Natl Acad Sci U S A. 2009 Mar 31;106(13):5300-5. doi: 10.1073/pnas.0808851106. Epub 2009 Mar 13. PMID: 19286971; PMCID: PMC2664017.
- DEVI, S.; ALEXANDRE, Y. O.; LOI, J. K.; GILLIS, R.; GHAZANFARI, N.; CREED, S. J.; HOLZ, L. E.; SHACKLEFORD, D.; MACKAY, L. K.; HEATH, W. R.; SLOAN, E. K.; MUELLER, S. N. Adrenergic regulation of the vasculature impairs leukocyte interstitial migration and suppresses immune responses. Immunity. 2021 Jun 8;54(6):1219-1230.e7. doi: 10.1016/j.immuni.2021.03.025. Epub 2021 Apr 28. PMID: 33915109.
- LAMMERMANN, T.; and SIXT, M. Mechanical modes of ‘amoeboid’ cell migration. Curr. Opin. Cell Biol. 2009 Oct;21(5):636-44. doi: 10.1016/j.ceb.2009.05.003.

- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










