Autores: Alexsander de Moraes e Cleyson da Cruz Oliveira Barros
Editado por Vânia Bonato
Referência:
Chikina, A. S.; Nadalin, F.; Maurin, M.; San-Roman, M.; Thomas-Bonafos, T.; Li, X. V.; Lameiras, S.; Baulande, S.; Henri, S.; Malissen, B.; Lacerda Mariano, L.; Barbazan, J.; Blander, J. M.; Iliev, I. D.; Matic Vignjevic, D.; Lennon-Duménil, A. M. Macrophages Maintain Epithelium Integrity by Limiting Fungal Product Absorption. Cell, v. 183, n.2, p.411-428. 2020. doi: 10.1016/j.cell.2020.08.048.
O intestino tem como função primária a absorção de nutrientes e água provenientes da alimentação, dentre outras moléculas, e posteriormente realizar a excreção do bolo fecal1. O processo de absorção ocorre na presença de ampla variedade de antígenos, provenientes dos alimentos, e da microbiota, sem que haja a quebra da integridade da barreira intestinal1. A quebra da barreira intestinal pode resultar no desenvolvimento de doenças inflamatórias intestinais, privação de nutrientes, quadros de sepse, ou mesmo falência múltipla de órgãos em determinados casos1-3. Nesse sentido, entender os mecanismos que regulam a homeostasia intestinal é muito importante.
Em um estudo publicado recentemente, Chikina e colaboradores4 reportaram uma nova função para macrófagos, crucial para manutenção da integridade da barreira intestinal do cólon, a região intestinal responsável, principalmente, pela absorção de fluidos, reabsorção de água e solidificação do bolo fecal. Curiosamente, tais macrófagos apresentaram morfologia nunca antes descrita, caracterizada pela presença de protusões similares a balões (BLP, do inglês “balloon-like” protrusions). Utilizando diferentes tipos de camundongos geneticamente modificados ou livres de germes, os autores realizaram elegantes ensaios baseados em microscopia, citometria de fluxo e sequenciamento de RNA de células únicas para a caracterização da função desse “novo guardião” do intestino: o macrófago BLP+.
Macrófagos BLP+ apresentaram perfil transcriptômico distinto, caracterizado, principalmente, pela alta expressão gênica da integrina CD11c e genes relacionados ao reconhecimento da microbiota e resposta inflamatória. Por meio de microscopia de fluorescência, os autores revelaram algo muito interessante: os macrófagos BLP+ estavam intimamente associados a células epiteliais do intestino, as quais são responsáveis pela absorção dos fluidos no cólon. Curiosamente, as BLPs se localizavam entre as células epiteliais e não atravessavam o epitélio até o lúmen intestinal; logo, são diferentes dos dendritos trans-epiteliais encontrados em células dendríticas do intestino. As diferenças não param por aí! Uma avaliação profunda das BLPs mostrou que estas continham membranas das células epiteliais e endossomos tardios em seu interior, indicando que macrófagos BLP+ estariam adquirindo componentes internos das células epiteliais adjacentes. De fato, os autores confirmaram por meio do ensaio de infusão intra-retal de camundongos com fluidos contendo moléculas fluorescentes, que as BLPs absorviam fluidos de forma indireta, através das células epiteliais. Esse fenômeno de absorção de fluidos, mediado por BLPs, também envolvia a aquisição de toxinas fúngicas, mas não bacterianas, absorvidas pelas células epiteliais. Tal fato foi relacionado com a manutenção da integridade da barreira intestinal nesse local, visto que, por algum mecanismo a ser elucidado, os macrófagos instruíam as células epiteliais a pararem a absorção do conteúdo tóxico. O papel relevante e novo dos macrófagos BLP+, contribuindo para manter a integridade da barreira intestinal, foi elegantemente comprovado por meio de experimentos com a depleção de tais macrófagos ou com a presença de macrófagos incapazes de formar BLPs. Nestas diferentes abordagens experimentais, os autores mostraram aumento significativo da morte de células epiteliais expostas a toxinas fúngicas, que resultava em aumento da permeabilidade intestinal.
Em conclusão, os autores preencheram uma importante lacuna no conhecimento sobre a manutenção da homeostasia da barreira epitelial via descrição de macrófagos BLP+, verdadeiros guardiões da integridade do cólon distal (Figura 1).
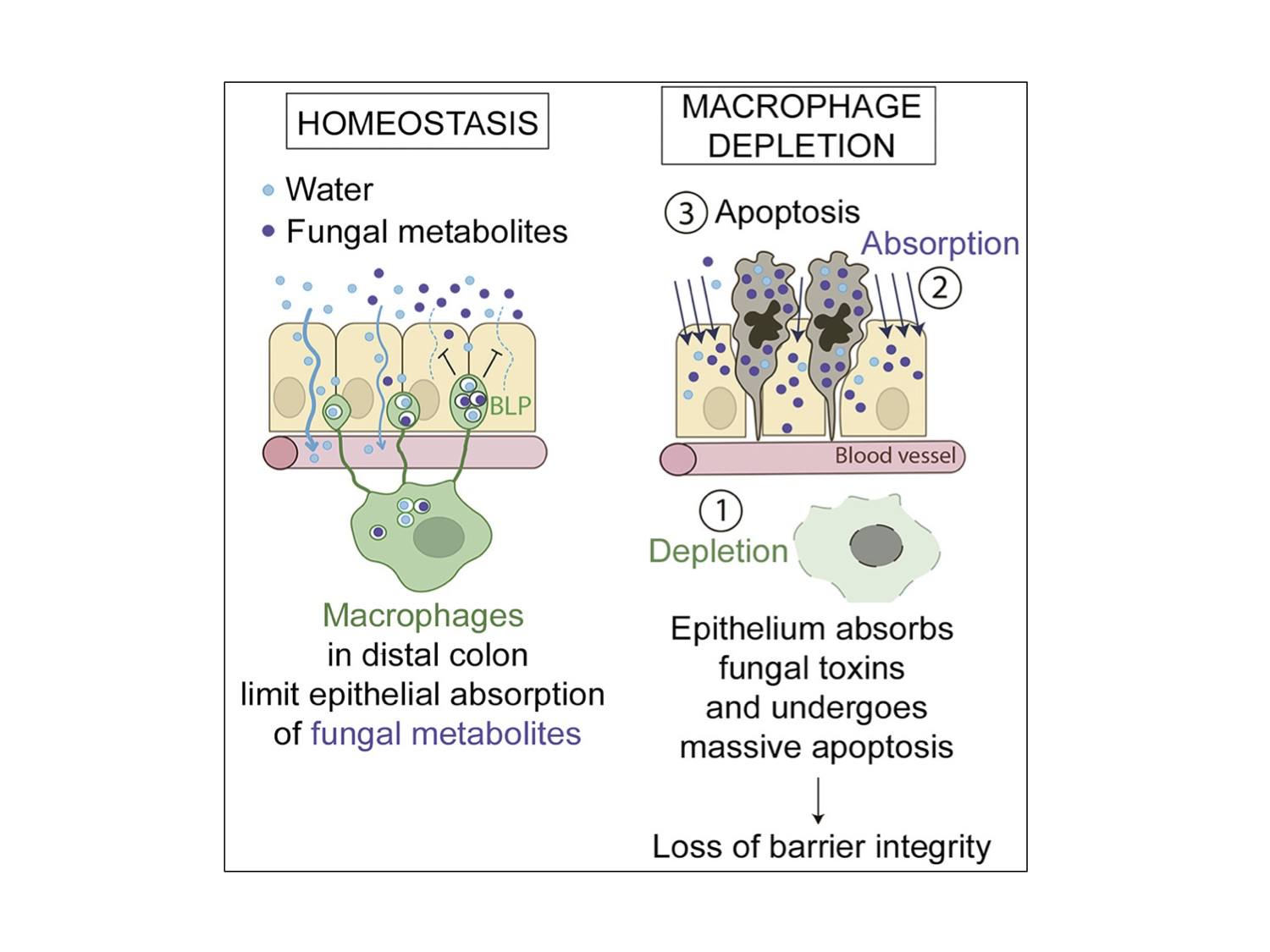
Figura 1. Representação esquemática do estudo de Chikina e colaboradores1. Em condições de homeostasia, macrófagos do cólon distal limitam a absorção de metabólitos/toxinas de origem fúngica por células epiteliais intestinais, utilizando protusões similares a balões (BLP). Na ausência de macrófagos no cólon distal (1), o epitélio intestinal absorve os metabólitos/toxinas de origem fúngica (2), que causam intensa morte celular (3), promovendo a perda da integridade da barreira intestinal.
Referências:
- Chelakkot, C.; Ghim, J.; Ryu, S. H. Mechanisms regulating intestinal barrier integrity and its pathological implications. Exp Mol Med., v.50, n.8, p.1-9. 2018. doi: 10.1038/s12276-018-0126-x.
- Yoseph, B. P.; Klingensmith, N. J.; Liang, Z.; Breed, E. R.; Burd, E.M.; Mittal, R.; Dominguez, J.A.; Petrie, B.; Ford, M.L.; Coopersmith, C. M. Mechanisms of Intestinal Barrier Dysfunction in Sepsis. Shock, v.46, n.1, p.52-59. 2016. doi: 10.1097/SHK.0000000000000565.
- Haussner, F.; Chakraborty, S.; Halbgebauer, R.; Huber-Lang, M. Challenge to the Intestinal Mucosa During Sepsis. Front Immunol., v.10, n.891. 2019. doi: 10.3389/fimmu.2019.00891.
- Chikina, A. S.; Nadalin, F.; Maurin, M.; San-Roman, M.; Thomas-Bonafos, T.; Li, X. V.; Lameiras, S.; Baulande, S.; Henri, S.; Malissen, B.; Lacerda Mariano, L.; Barbazan, J.; Blander, J. M.; Iliev, I. D.; Matic Vignjevic, D.; Lennon-Duménil, A. M. Macrophages Maintain Epithelium Integrity by Limiting Fungal Product Absorption. Cell, v. 183, n.2, p.411-428. 2020. doi: 10.1016/j.cell.2020.08.048.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










