Autores: André Correa e Larissa Andrade
Editor: Ademilson Panunto Castelo
Seminário apresentado na disciplina Tópicos Avançados de Imunologia do Programa de Pós-Graduação em Imunologia Básica e Aplicada da FMRP-USP.
Em estudo intitulado “Intraepithelial mast cells drive gasdermin C-mediated type 2 immunity”, publicado em maio de 2024 no periódico Immunity, Liu Yang e cols.2 revelaram funções até então não conhecidas de mastócitos intraepiteliais (IEMCs), envolvendo a comunicação dessas células com células epiteliais intestinais (IECs). O estudo permite avançar em nossa compreensão dos mecanismos celulares subjacentes à ativação da gasdermina C em IECs e a liberação de alarminas.
A imunidade do tipo 2 é observada principalmente diante de infecções causadas por helmintos e em processos alérgicos. As infecções helmínticas continuam sendo um grande problema de saúde para humanos, afetando cerca de 24% da população global, especialmente em países em desenvolvimento. Para o controle da maioria dessas infecções, as células epiteliais intestinais (IECs) são a primeira linha de defesa, tanto como barreira física quanto “sensor” de componentes dos parasitas. A partir da percepção desses organismos, IECs iniciam uma resposta imunológica do tipo 2 com produção de alarminas, tais como interleucina (IL-) 25, linfopoietina estromal tímica (TSLP) e IL-33. Esse processo conta com o auxílio dos mastócitos, células da imunidade inata presentes no tecido conjuntivo que, em conjunto com as IECs, possuem função de “sentinelas”. As alarminas secretadas por IECs promovem a expansão e funcionalidade das células linfoides inatas do grupo 2 (ILC2s), que direcionam a diferenciação das células-tronco intestinais para células tufo e caliciformes, tendo como resultado a secreção abundante de muco e, consequente, expulsão dos parasitas.
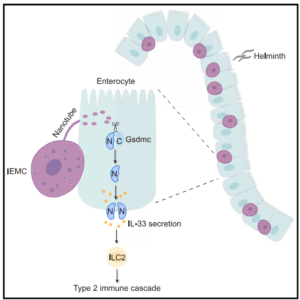
Apesar desse conhecimento, até então não estava muito claro como mastócitos participam desse processo que leva a secreção da alarmina IL-33 por IECs, o que foi estudado por Yang e colaboradores (2024).2 Neste estudo, os autores observaram que a infecção de camundongos com Heligmosomoides polygyrus, um nematódeo que parasita roedores se instalando no intestino delgado desses animais, levava a um aumento de mastócitos que apresentam a protease 1 de mastócitos (Mcpt1) intestinais. Esses mastócitos possuíam localização intraepitelial (IEMCs) e apresentavam expressão diferencial de marcadores de superfície Mcpt1 e da integrina β7αE em relação aos mastócitos presentes na lâmina própria (LPMCs). Os autores mostraram que as IEMCs estabelecem comunicação com células epiteliais através de estruturas nanotubulares, de modo a permitir a transferência de proteínas, tal como a Mcpt1, para as IECs. Por análises de sequenciamento de RNA, o grupo observou aumento na expressão de genes associados à Gasdermina c (Gsdmc) diante da infecção por H. polygyrus e, por isso, buscaram investigar a associação dessa proteína com o processo de transferência de Mcpt1 dos IEMCs para IECs e liberação de IL-33. Por meio de experimentos de cocultura, foi demonstrado que essa comunicação é importante para a transferência de proteases de IEMCs para as IECs, o que leva a clivagem de Gsdmc nessas IECs. Tal mecanismo foi confirmado in vivo pelo uso de ferramentas de manipulação genética, com camundongos deficientes em mastócitos (KitW-sh/W-sh). Embora seja amplamente conhecido que gasderminas possuem papel na morte celular, o grupo observou que, de maneira contrária, a ativação dessa proteína diante da infecção por H. polygyrus não induz necroptose, apoptose ou piroptose.
Para melhor demonstração da via acionada diante da resposta imunológica do tipo 2, os autores investigaram possíveis alterações na liberação da alarmina IL-33. Mostraram que camundongos deficientes em Gsdmc apresentam maior retenção de IL-33 nas IECs, menor número de células tufo e comprometimento na expressão de ST2, receptor da IL-33, nas células ILC2 produtoras de IL-13. Por fim, o grupo mostrou que a Mcpt1 é a enzima-chave na clivagem da Gsdmc nas IECs, uma vez que animais Mcpt1−/− mostraram um aumento na retenção de IL-33 nas IECs e menor ativação de ILC2s, correlacionado à ausência de clivagem da Gsdmc.
As descobertas revelam uma conexão crucial entre os mastócitos intraepiteliais e a ativação da Gsdmc nas células epiteliais, necessária para a liberação de IL-33 durante a imunidade do tipo 2 (Figura 1). A interação mastócito-epitélio é essencial para a clivagem e ativação da Gsdmc, mediada pela Mcpt1, e subsequente liberação de IL-33, destacando o papel vital dos IEMCs na resposta imunológica do tipo 2. Estas descobertas abrem novas perspectivas para o estudo dos mastócitos em diversos contextos fisiológicos e patológicos, proporcionando uma melhor compreensão das respostas imunológicas mucosas e potencialmente novas abordagens terapêuticas para infecções helmínticas.
Figura 1. A presença dos mastócitos intraepiteliais (IEMCs) no epitélio intestinal possibilita a comunicação com as células epiteliais (IECs). As IEMCs liberam enzimas, como a Mcpt1, para as IECs via nanotúbulos, processo que induz a clivagem e ativação de gasdermina C, que favorece a liberação de IL-33 e posterior ativação das ILC2 residentes no tecido, possibilitando a geração de resposta imunológica do tipo 2. Fonte: Yang et al., 2024.2
Referências bibliográficas
- Zaini A, Harris NL. A new superhero, the intraepithelial mast cell, joins the "Guardians of the Gut". Immunity, v.57, n.5, p. 935-937, 2024. doi: 10.1016/j.immuni.2024.04.020. (Título do post é uma versão desse Preview escrito a respeito do artigo de Yang e cols.2)
- Yang L, He H, Guo XK, Wang J, Wang W, Li D, Liang S, Shao F, Liu W, Hu X.Intraepithelial mast cells drive gasdermin C-mediated type 2 immunity. Immunity, v.57, n.5, p.1056-1070.e5, 2024. doi: 10.1016/j.immuni.2024.03.017.
1



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)