Por: Allana Ferreira da Costa Pessoa e Leonardo Lima Santos (Doutorandos IBA/FMRP-USP)
Editora: Luciana Benevides
A artrite reumatoide é caracterizada por uma inflamação crônica com destruição progressiva das articulações (1). Embora terapias eficazes tenham sido introduzidas, uma fração significativa de pacientes com artrite reumatoide é refratária às terapias existentes (2). Estudos têm associado a presença de polimorfismos de nucleotídeo único (SNP’s) em genes que compõem a via de englobamento de células apoptóticas (Figura 1) como possíveis causas para a resistência ao tratamento e desenvolvimento da doença (3,4). No entanto, ainda não foi esclarecido como os componentes da via de englobamento de células apoptóticas poderiam atuar na artrite reumatoide.
Arandjelovic e colaboradores (5) avaliaram o papel dos componentes da via de englobamento de células apoptóticas na artrite reumatoide. Inicialmente, foi visto uma alta frequência de SNP’s no gene Elmo1 que compõe a via de sinalização de englobamento de células apoptóticas associado a artrite reumatoide. Contrariando dados anteriores já publicados, camundongos com deficiência de Elmo1 mostraram redução da inflamação articular em modelos de artrite aguda e crônica. Análises moleculares revelaram que Elmo1 se associa a receptores ligados à função de neutrófilos regulando a sua ativação e recrutamento para as articulações, sem inibir a inflamação em modelo de arttite em camundongos. Além disso, neutrófilos do sangue periférico de doadores humanos que carregam o SNP’s em Elmo1 exibiram uma maior capacidade migratória, enquanto o silenciamento de Elmo1 reduziu a migração de neutrófilos humanos mediados por leucotrieno B4 produzidos durante artrite. Esses dados identificam os papéis "não-canônicos" de Elmo1 como um importante regulador da artrite por meio da função de neutrófilos.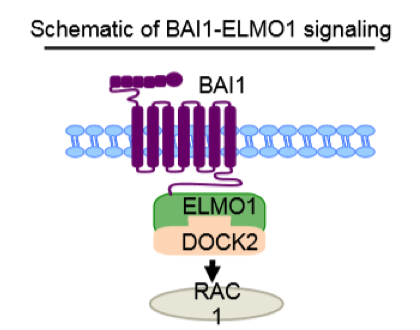
Figura 1: Representação esquemática da via de sinalização celular para o englobamento de células apoptóticas. O complexo de proteínas ELMO1 – DOCK2 – RAC1 atua “downstream” ao receptor BAI1 promovendo o rearranjo do citoesqueleto de fagócitos necessário para o englobamento de células apoptóticas.
Referências
- MCINNES, IB & SCHETT, G. The pathogenesis of rheumatoid arthritis. N. Eng. J. Med. 365, 2205–2219 (2011).
- MOOTS, RJ & NAISBETT-GROET, B. The efficacy of biologic agents in patients with rheumatoid arthritis and an inadequate response to tumour necrosis factor inhibitors: a systematic review. Rheumatology (Oxford) 51, 2252–2261 (2012).
- DING J, EYRE S, WORTHINGTON J. Genetics of RA susceptibility, what comes next?. RMD Open 1, e000028 (2015).
- ARANDJELOVIC, S. & RAVICHANDRAN, KS. Phagocytosis of apoptotic cells in homeostasis. Nat. Immunol. 16, 907–917 (2015).
- ARANDJELOVIC S, PERRY JSA, PENBERTHY KK, KIM TH, ZHOU M, ROSEN DA, CHUANG TY, BETTINA AM, SHANKMAN LS, COHEN AH, GAULTIER A, CONRADS TP, KIM M, ELLIOT MR, RAVICHANDRAN KS. A noncanonical role for the engulfment gene ELMO1 in neutrophils that promotes inflammatory arthritis. Nat. Immunol. 20, 141-151 (2019).



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










